
| A. | a=b | B. | c(H+)=c(OH-)=10-7mol/L | ||
| C. | 混合液中Kw=c2(OH-) | D. | c(H+)+c(B+)=c(OH-)+c(A-) |
分析 中性溶液中一定滿足c(H+)=c(OH-),則Kw=c(H+)•c(OH-)=c2(OH-);由于溫度未知,則中性時c(H+)、c(OH-)不一定為10-7mol/L;任何溶液中都滿足電荷守恒,無法據此判斷溶液是否為中性,據此進行解答.
解答 解:A.a=b時不一定為中性,如:HA為弱酸、BOH為強堿時,兩溶液等濃度、等體積混合后生成強堿弱酸鹽,溶液為堿性,故A錯誤;
B.中性溶液中一定滿足c(H+)=c(OH-),由于不是常溫下,則(H+)、c(OH-)不一定等于10-7mol/L,故B錯誤;
C.中性溶液中c(H+)=c(OH-),則Kw=c(H+)•c(OH-)=c2(OH-),故C正確;
D.無論溶液呈酸性、堿性還是中性,一定滿足電荷守恒:c(H+)+c(B+)=c(OH-)+c(A-),故D錯誤;
故選C.
點評 本題考查了溶液酸堿性與溶液pH的計算與判斷,題目難度中等,明確溶液酸堿性與溶液pH的關系為解答關鍵,注意掌握電荷守恒、物料守恒的含義及應用,B為易錯點,注意溫度對水的離子積的影響.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 石油、沼氣、天然氣、植物油都屬于可再生能源 | |
| B. | 應用蓋斯定律,可計算某些難以直接測量的反應焓變 | |
| C. | 水蒸氣變為液態水時放出的能量就是該變化的反應熱 | |
| D. | 同溫同壓下,H2(g)+Cl2(g)═2HCl(g)在光照和點燃條件下的△H不同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
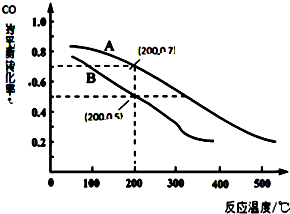 科學家開發出一種“潔凈煤技術”,通過向地下煤層“氣化爐”中交替鼓入空氣和水蒸氣的方法,連續產出高熱值的煤炭氣,其主要成分是CO和H2.“氣化爐”中主要反應有:
科學家開發出一種“潔凈煤技術”,通過向地下煤層“氣化爐”中交替鼓入空氣和水蒸氣的方法,連續產出高熱值的煤炭氣,其主要成分是CO和H2.“氣化爐”中主要反應有:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 在一定溫度和壓強條件下發生了反應:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0,反應達到平衡時,改變溫度(T)和壓強(p),反應混合物CH3OH“物質的量分數”變化情況如圖所示,關于溫度(T)和壓強(p)的關系判斷正確的是( )
在一定溫度和壓強條件下發生了反應:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0,反應達到平衡時,改變溫度(T)和壓強(p),反應混合物CH3OH“物質的量分數”變化情況如圖所示,關于溫度(T)和壓強(p)的關系判斷正確的是( )| A. | P3>P2T3>T2 | B. | P2>P4T4>T2 | C. | P1>P3T3>T1 | D. | P1>P4T2>T3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1000 mL,514.00 g | B. | 480 mL,198.72 g | ||
| C. | 500 mL,207.00 g | D. | 任意規格,207.00 g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 放電時Pb極為負極 | |
| B. | 充電時蓄電池上標有“+”號電極連接電源正極 | |
| C. | 放電時正極反應為PbO2+SO42-+4H++2e═PbSO4+2H2O | |
| D. | 充電時蓄電池上標有“-”號的電極發生氧化反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該溶液中:c(OH-)>c(Na+)>c(CO32-)>c(HCO3-)>c(H+) | |
| B. | 該溶液中:c(Na+)+c(H+)═c(OH-)+2c(CO32-)+c(HCO3-) | |
| C. | 加水稀釋該溶液,恢復至原溫度,pH增大,Kw不變 | |
| D. | 該溶液pH約為13的原因:CO32-+H2O═HCO3-+OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
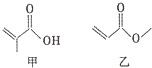
| A. | 甲、乙互為同分異構體 | |
| B. | 甲、乙都能與溴的單質發生加成反應 | |
| C. | 一定條件下,甲、乙均能發生取代反應 | |
| D. | 甲、乙都能與金屬鈉反應生成氫氣 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com