
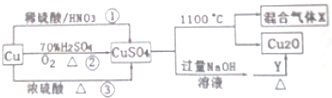
分析 (1)途徑②中Cu與氧氣反應生成CuO,再與硫酸反應生成硫酸銅和水,不生成有毒氣體;
(2)由轉化可知,生成的氫氧化銅轉化為氧化亞銅,Cu元素的化合價降低,則Y中某元素的化合價升高;
(3)硫酸銅分解生成Cu2O,Cu元素的化合價降低,S元素為最高價不能升高,所以O元素的化合價升高;
(4)發生3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,離子反應為:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,以此來解答.
解答 解:(1)途徑①中Cu與硝酸反應生成有毒的NO氣體、③中銅和濃硫酸反應會生成二氧化硫氣體污染空氣,途徑②的優點:制取等質量膽礬需要的硫酸少、途徑②無污染性氣體產生,更好地體現了綠色化學思想,故答案為:②;
(2)Y可能為葡萄糖或醛,若為葡萄糖,發生C6H12O6+2Cu(OH)2=C6H12O7+Cu2O+2H2O,Cu元素的化合價降低,則Y中某元素的化合價升高,則Y具有還原性,
故答案為:還原性;
(3)硫酸銅分解生成Cu2O,Cu元素的化合價降低,S元素為最高價不能升高,所以O元素的化合價升高,即有氧氣生成,發生2CuSO4═Cu2O+SO2↑+SO3↑+O2↑,所得混合氣體X中一定有SO2與O2,故答案為:SO2與O2;
(4)Cu與混酸反應,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,離子反應為:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,從方程式知,硝酸根離子由硝酸提供,氫離子由硝酸和硫酸提供,所以硝酸為2mol時,硫酸為3mol,用混酸中H2SO4與HNO3物質的量之比最好為3:2,
故答案為:3:2;3Cu3++8H++2NO3-=3Cu2++2NO↑+4H2O.
點評 本題考查制備實驗及物質的性質,為高頻考點,把握制備反應原理、物質的性質為解答的關鍵,側重分析與實驗能力的考查,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol/L的NaOH溶液與0.2 mol/L的HCN溶液等體積混合,所得溶液呈堿性:c (Na+)>c (CN-)>c (HCN)>c (OH-)>c (H+) | |
| B. | 20 mL 0.1 mol/L的Na2CO3溶液與等體積等濃度的鹽酸混合充分反應后的溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)=2c(Cl-)=0.1 mol/L | |
| C. | 濃度均為1 mol/L的以下溶液:①醋酸 ②NaOH溶液 ③鹽酸 ④醋酸鈉溶液,其水的電離程度的關系為:④>①>③>② | |
| D. | 相同溫度下,pH值相同的CH3COONa溶液與NaHCO3溶液一定存在關系:c(CH3COO-)=c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
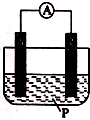 如圖所示裝置中,可觀察到電流表指針偏轉;M棒變粗,N棒變細,由此判斷下表所列M、N、P物質,其中可以成立的是 ( )
如圖所示裝置中,可觀察到電流表指針偏轉;M棒變粗,N棒變細,由此判斷下表所列M、N、P物質,其中可以成立的是 ( )| 選項 | M | N | P |
| A | 鋅 | 銅 | 稀硫酸溶液 |
| B | 銅 | 鋅 | 稀鹽酸 |
| C | 銀 | 鋅 | 硝酸銀溶液 |
| D | 鋅 | 鐵 | 硝酸鐵溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質子數為7、中子數為8的氮原子:${\;}_{7}^{8}$N | |
| B. | 溴化銨的電子式: | |
| C. | 氮原子的結構示意圖: | |
| D. | 間硝基甲苯的結構簡式: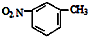 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解飽和食鹽水時,陽極的電極反應式為:2Cl--2e-═Cl2↑ | |
| B. | 氫氧燃料電池的負極反應式:O2+4H++4e-═2H2O | |
| C. | 粗銅精煉時,與電源正極相連是純銅,電極反應式為Cu-2e-═Cu2+ | |
| D. | 鋼鐵發生電化學腐蝕的正極反應式:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 服用鉻含量超標的藥用膠囊會對人對健康造成危害 | |
| B. | 食用一定量的油脂能促進人體對某些維生素的吸收 | |
| C. | “血液透析”利用了膠體的性質 | |
| D. | 使用填埋法處理未經分類的生活垃圾 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
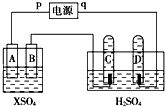 如圖,p、q為直流電源的兩極,A由+2價金屬單質X制成,B、C、D為鉑電極,接通電源,金屬X沉積于B極,同時C、D極上均產生氣泡,試回答:
如圖,p、q為直流電源的兩極,A由+2價金屬單質X制成,B、C、D為鉑電極,接通電源,金屬X沉積于B極,同時C、D極上均產生氣泡,試回答:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com