
| 滴定次數 | NaOH溶液體積/mL | 滴定消耗濾液體積/mL |
| 1 | 25.00 | 20.02 |
| 2 | 25.00 | 17.10 |
| 3 | 25.00 | 19.98 |
分析 (1)根據反應物和生成物結合質量守恒定律來書寫化學方程式;
(2)根據所配溶液的體積選擇容量瓶;
(3)根據溶液顏色變化且半分鐘內不變色,可說明達到滴定終點;
(4)先計算NaOH的濃度,由于第二次滴定時數據與另外兩次差別較大,舍去,則消耗濾液的體積平均值為$\frac{20.02+19.98}{2}$=20.00mL,根據c(濾液)=$\frac{c(NaOH)V(NaOH)}{V(濾液)}$計算;
(5)俯視標準液液面,則濾液的體積偏小,根據c(濾液)=$\frac{c(NaOH)V(NaOH)}{V(濾液)}$分析誤差.
解答 解:(1)TiCl4水解生成TiO2•xH2O,設TiCl4的系數為1,根據元素守恒,TiO2•xH2O的系數為1,HCl的系數為4;再根據O元素守恒,可知H2O的系數為(2+x),
故答案為:TiCl4+(x+2)H2O?TiO2•xH2O+4HCl;
(2)配制成250mL溶液使用的量具是250mL容量瓶,故答案為:250mL容量瓶;
(3)酚酞在氫氧化鈉溶液中顯紅色,隨著反應進行堿性減弱,溶液顏色變淺,當溶液顏色由粉紅色變為無色,且半分鐘內不變色,可說明達到滴定終點,
故答案為:淺紅色溶液變為無色,且半分鐘內不變色;
(4)1.000gNaOH固體質量,配制成250mL溶液,則c(NaOH)=$\frac{n}{V}$=$\frac{\frac{1g}{40g/mol}}{0.25L}$=0.1mol/L,
第二次滴定時數據與另外兩次差別較大,舍去,則消耗濾液的體積平均值為$\frac{20.02+19.98}{2}$=20.00mL,
則c(濾液)=$\frac{c(NaOH)V(NaOH)}{V(濾液)}$=$\frac{0.1mol/L×0.025L}{0.02L}$=0.125 mol•L-1,
故答案為:0.125 mol•L-1;
(5)若在滴定終點讀取滴定管刻度時,俯視液面,則滴定管中讀出的濾液的體積偏小,由c(濾液)=$\frac{c(NaOH)V(NaOH)}{V(濾液)}$可知,計算結果偏大,即測定結果偏高,
故答案為:偏高.
點評 本題考查酸堿中和滴定,明確中和滴定實驗的儀器、步驟、終點的判定、數據處理等即可解答,注意滴定管的讀數為易錯點,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | K2SO4•2Cr2(SO4)3 | B. | 2K2SO4•Cr2(SO4)3 | C. | K2SO4•Cr2(SO4)3 | D. | K2SO4•$\frac{1}{2}$Cr2(SO4)3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
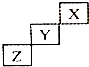
| A. | X是種活潑的非金屬元素 | |
| B. | Z的最高價氧化物的水化物是一種弱酸 | |
| C. | Y的氫化物很穩定 | |
| D. | Y元素的最高化合物為+7價 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | FeCl3溶液 | B. | 溴水 | ||
| C. | 酸性高錳酸鉀溶液 | D. | NaOH溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯甲酸的重結晶實驗中要得到純凈的苯甲酸固體需要進行兩次過濾操作 | |
| B. | 實驗室制乙烯時,為減弱濃硫酸對有機物的碳化作用,應用小火緩慢加熱 | |
| C. | 在石油的分餾、制硝基苯、制乙烯的實驗中,都要使溫度計的水銀液泡浸入反應液中,以控制實驗溫度 | |
| D. | 制備硝基苯,混合藥品的順序為:向試管中先加入苯,再加入濃硫酸,最后加入濃硝酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學式為CF2Cl2的物質可以看作是甲烷的衍生物,它有兩種分子結構 | |
| B. | 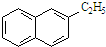 所有原子都處于同一平面 所有原子都處于同一平面 | |
| C. | C3H8O有2種同分異構體 | |
| D. | 甲苯的二氯代物共有10種 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{n}{16}$ | B. | $\frac{n}{8}$ | C. | 4n | D. | 8n |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com