
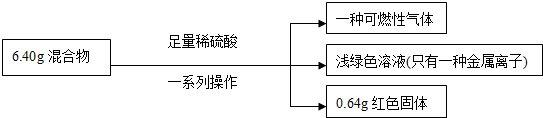
| A. | 原混合物中銅元素的質量不一定為0.64g | |
| B. | 生成氣體體積為2.016L | |
| C. | 實驗中反應的硫酸的物質的量為0.1mol | |
| D. | 原混合物中鐵的質量分數為87.5% |
分析 生成可燃性氣體,說明鐵粉過量,發生反應:Fe+H2SO4=FeSO4+H2↑,反應后的溶液為淺綠色,且只有一種金屬離子,則發生反應CuO+H2SO4=CuSO4+H2O后,又發生CuSO4+Fe=FeSO4+Cu,且Cu被完全置換;根據Cu的質量計算CuO質量,進而計算Fe的質量,根據電子轉移計算生成氫氣的質量.
解答 解:生成可燃性氣體,說明發生反應Fe+H2SO4=FeSO4+H2↑,溶液為淺綠色,只有一種金屬離子,則發生CuO+H2SO4=CuSO4+H2O后,又發生CuSO4+Fe=FeSO4+Cu,且Cu被完全置換,
生成0.64gCu,其物質的量:$\frac{0.64}{g64g/mol}$=0.01mol,由Cu元素守恒可知n(CuO)=n(Cu)=0.01mol,
故混合物中:m(CuO)=0.01mol×80g/mol=0.8g,則:m(Fe)=6.40g-0.8g=5.6g,n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,
A.根據分析可知,銅的質量為0.64g,故A錯誤;
B.設氫氣的物質的量為nmol,根據電子轉移守恒可得:2n+0.01mol×2=0.1mol×2,解得n=0.09mol,沒有告訴在標準狀況下,不能使用標準狀況下氣體摩爾體積計算氫氣體積,故B錯誤;
C.鐵的物質的量為0.1mol,反應生成溶質為硫酸亞鐵,則反應消耗的硫酸的物質的量為0.1mol,故C正確;
D.由上述分析可知,Fe的質量為5.6g,混合物中Fe的質量分數為:$\frac{5.6g}{6.4g}$×100%=87.5%,故D正確;
故選CD.
點評 本題考查了混合物反應的計算,題目難度中等,明確發生反應的原理為解答關鍵,注意掌握守恒思想在化學計算中的應用,試題培養了學生的化學計算能力.


 寒假大串聯黃山書社系列答案
寒假大串聯黃山書社系列答案 寒假創新型自主學習第三學期寒假銜接系列答案
寒假創新型自主學習第三學期寒假銜接系列答案科目:高中化學 來源: 題型:選擇題
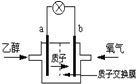 2004年美國圣路易斯大學研制了一種新型的乙醇電池,它用磺酸類質子溶劑,在200°C左右時供電,乙醇電池比甲醇電池效率高出32倍且更安全.電池總反應為:C2H5OH+3O2═2CO2+3H2O,電池示意如圖,下列說法不正確的是( )
2004年美國圣路易斯大學研制了一種新型的乙醇電池,它用磺酸類質子溶劑,在200°C左右時供電,乙醇電池比甲醇電池效率高出32倍且更安全.電池總反應為:C2H5OH+3O2═2CO2+3H2O,電池示意如圖,下列說法不正確的是( )| A. | 電池工作時,1mol乙醇被氧化時就有6mol電子轉移 | |
| B. | a極為電池的負極 | |
| C. | 電池工作時電流由b極沿導線經燈泡再到a極 | |
| D. | 電池正極的電極反應為:4H++O2+4e-═2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
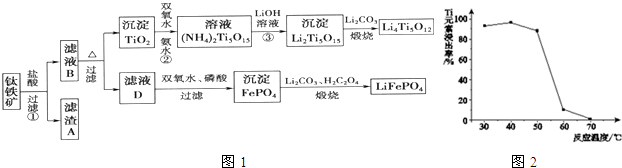
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入氯化鋇溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,則原溶液中一定有SO42- | |
| B. | 加入燒堿溶液后加熱,產生能使濕潤的紅色石蕊試紙變藍的氣體,則原溶液中一定有NH4+ | |
| C. | 加入鹽酸,放出能使澄清的石灰水變渾濁的無色的氣體,則原溶液中一定含有CO32- | |
| D. | 加入AgNO3溶液,有白色沉淀生成,在原溶液中一定含有Cl- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com