
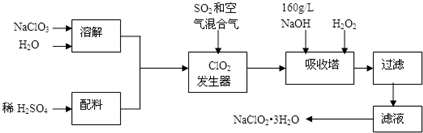
分析 由制備實驗流程可知,固體溶解后與酸混合,在發生器內發生氧化還原反應生成ClO2和Na2SO4,在吸收塔內發生2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑,NaClO2的溶解度隨溫度升高而增大,適當條件下可結晶析出產品NaClO2•3H2O,
(1)ClO2發生器中NaClO3與SO2發生氧化還原反應生成ClO2和Na2SO4;由信息②可知,純ClO2易分解爆炸,一般用稀有氣體或空氣稀釋到10%以下安全.據此解答;
(2)根據題目信息并運用氧化還原反應理論判斷反應物、生成物;根據流程信息可知,吸收塔內生成NaClO2,一定有ClO2→NaClO2,化合價降低,被還原;則H2O2必定被氧化,有氧氣產生,據此書寫方程式;溫度過高,H2O2容易分解;
(3)還原性要適中.還原性太強,會將ClO2還原為更低價態產物,影響NaClO2生產;方便后續分離提純,加入試劑不能干擾后續生產,Na2O2溶于水相當于H2O2;
(4)從溶液中得到含結晶水的晶體,只能采取蒸發、濃縮、冷卻結晶方法,通過過濾得到粗晶體,得到的粗晶體經過重結晶可得到純度更高的晶體;
(5)①因為是用Na2S2O3標準液滴定至終點,反應是I2+2S2O32-=2I-+S4O62-,I2與指示劑淀粉產生藍色,故終點是滴加最后一滴液體時溶液由藍色變成無色且半分鐘內不變色;
②由反應中的I元素守恒可知:ClO2-~2I2~4 S2O32-,25.00mL待測溶液中n(NaClO2)=$\frac{1}{4}$×cV×10-3mol,m(NaClO2)=$\frac{1}{4}$×90.5cV×10-3g;樣品mg配成250mL待測溶液中的NaClO2質量擴大10倍,計算得到NaClO2的質量分數.
解答 解:(1)ClO2發生器中NaClO3與SO2發生氧化還原反應生成ClO2和Na2SO4,其反應的離子方程式為:2ClO3-+SO2=2ClO2+SO42-;
由信息②可知,純ClO2易分解爆炸,一般用稀有氣體或空氣稀釋到10%以下安全.發生器中鼓入空氣的作用應是稀釋ClO2以防止爆炸,
故答案為:2ClO3-+SO2=2ClO2+SO42-;c;
(2)根據流程信息可知,吸收塔內生成NaClO2,所以一定有ClO2→NaClO2,化合價降低,被還原;則H2O2必定被氧化,有氧氣產生,反應方程式為:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑;
H2O2不穩定,溫度過高,H2O2容易分解,吸收塔的溫度不能超過20℃,其目的是防止H2O2分解,
故答案為:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑;防止H2O2分解;
(3)還原性要適中.還原性太強,會將ClO2還原為更低價態產物,影響NaClO2生產;方便后續分離提純,加入試劑不能干擾后續生產,Na2O2溶于水相當于H2O2;Na2S、FeCl2還原性較強,而生成物與NaClO2分離比較困難,
故答案為:a;
(4)從溶液中得到含結晶水的晶體,只能采取蒸發、濃縮、冷卻結晶方法,通過過濾得到粗晶體,
故答案為:蒸發濃縮、冷卻結晶、過濾;
(5)①因為是用Na2S2O3標準液滴定至終點,反應是I2+2S2O32-=2I-+S4O62-,I2與指示劑淀粉產生藍色,故終點是滴加最后一滴液體時溶液由藍色變成無色且半分鐘內不變色;
故答案為:滴加最后一滴液體時溶液由藍色變成無色且半分鐘內不變色;
②由反應中的I元素守恒可知:ClO2-~2I2~4 S2O32-,25.00mL待測溶液中n(NaClO2)=$\frac{1}{4}$×cV×10-3mol,m(NaClO2)=$\frac{1}{4}$×90.5cV×10-3g;樣品mg配成250mL待測溶液中的NaClO2質量擴大10倍,故樣品中NaClO2的質量分數為$\frac{\frac{1}{4}×90.5cV×1{0}^{-2}g}{mg}$×100%=$\frac{22.625cV}{m}$%,
故答案為:$\frac{22.625cV}{m}$%.
點評 本題考查物質的制備實驗,為高頻考點,把握物質的性質、發生的反應、混合物分離及關系式計算為解答的關鍵,側重分析與應用能力的考查,注意氧化還原反應的應用,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,則可知C的標準燃燒熱為110.5 kJ•mol-1 | |
| B. | 在101KPa下氫氣的標準燃燒熱△H=-285.5 kJ•mol-1,則水分解的熱化學方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 稀硫酸與0.1 mol/LNaOH溶液反應:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1 | |
| D. | 密閉容器中,9.6 g硫粉與11.2 g鐵粉混合加熱生成硫化亞鐵17.6 g時,放出19.12 kJ熱量.則Fe(s)+S(g)=FeS(s)△H=-95.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 第一次 | 第二次 | 第三次 | |
| 體積(mL) | 16.10mL | 16.60mL | 15.90mL |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 +CaCl2+H2O,該反應的原子利用率25.4%.
+CaCl2+H2O,該反應的原子利用率25.4%. ,
, )與乙二醇作用,可生成一系列化合物:
)與乙二醇作用,可生成一系列化合物: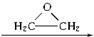 HO-CH2-CH2-O-CH2-CH2-OH
HO-CH2-CH2-O-CH2-CH2-OH
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 開始沉淀pH | 3.4 | 1.8 | 7.5 | 7.2 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 取100mL5mol/LH2SO4,加入400mL水 | |
| B. | 取200mL5mol/LHCl,加水稀釋至500mL | |
| C. | 取200 mL5mol/LH2SO4,加水稀釋至500mL | |
| D. | 取100 mL5mol/LHNO3,加水稀釋至500mL |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 通入過量Cl2:Fe2+、H+、NH4+、Cl-、SO42- | |
| B. | 加入少量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO- | |
| C. | 加入過量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH- | |
| D. | 加入過量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com