

 +CaCl2+H2O,該反應的原子利用率25.4%.
+CaCl2+H2O,該反應的原子利用率25.4%. ,
, )與乙二醇作用,可生成一系列化合物:
)與乙二醇作用,可生成一系列化合物: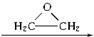 HO-CH2-CH2-O-CH2-CH2-OH
HO-CH2-CH2-O-CH2-CH2-OH
分析 (1)氯氣與水反應生成氯化氫和次氯酸,次氯酸化為乙烯和次氯酸的加成反應,生成2-氯乙醇;
(2)2-氯乙醇和氫氧化鈣反應生成環氧乙烷、氯化鈣和水,環氧乙烷沸點10.4℃.與水任意比例互溶,通過操作1蒸餾的方法獲得環氧乙烷,根據蒸餾操作選擇所需儀器;
(3)氯醇法為乙烯和氯氣和堿反應,生成環氧乙烷和氯化鈣和水,根據原子利用率=$\frac{預期產物的總質量}{全部反應物的總質量}$×100%計算;
(4)乙烯在銀作催化劑的作用下一步生成環氧乙烷鈉,綠色化學要求反應物原子盡可能轉化成生成物;
(5)根據有機物的結構簡式求出通式為:C2nH 4n+2On,然后運用極限法求出質量分數的最大值.
解答 解:(1)氯氣與水反應生成氯化氫和次氯酸,反應的離子方程式為:Cl2+H2O=H++Cl-+HClO,次氯酸是共價化合物,氧原子與氫原子、氯原子分別通過1對共用電子對結合,結構式為H-O-Cl,乙烯的次氯酸化為乙烯和次氯酸的加成反應,所以總反應方程式為:CH2=CH2+Cl2+H2O→ClCH2CH2OH+HCl,
故答案為:CH2=CH2+Cl2+H2O→ClCH2CH2OH+HCl;加成反應;
(2)乙烯的次氯酸化,加入氫氧化鈣,鹽酸和氫氧化鈣反應生成氯化鈣和水,2-氯乙醇和氫氧化鈣反應:ClCH2CH2OH+Ca(OH)2→ +CaCl2+H2O,環氧乙烷沸點10.4℃.與水任意比例互溶,互溶的液體可利用沸點的不同進行蒸餾分離,所以操作1為蒸餾,蒸餾操作需要冷凝管冷凝環氧乙烷,需錐形瓶接受環氧乙烷,所以選擇CE,
+CaCl2+H2O,環氧乙烷沸點10.4℃.與水任意比例互溶,互溶的液體可利用沸點的不同進行蒸餾分離,所以操作1為蒸餾,蒸餾操作需要冷凝管冷凝環氧乙烷,需錐形瓶接受環氧乙烷,所以選擇CE,
故答案為:蒸餾;CE;
(3)氯醇法為乙烯和氯氣和堿反應,氯氣和氫氧化鈣反應生成氯化鈣、次氯酸鈣和水,乙烯和次氯酸鈣反應生成環氧乙烷,所以總反應方程式為:CH2=CH2+Cl2+Ca(OH)2→ +CaCl2+H2O,該反應的原子利用率=$\frac{預期產物的總質量}{全部反應物的總質量}$×100%=$\frac{44}{28+71+74}$×100%≈25.4%,
+CaCl2+H2O,該反應的原子利用率=$\frac{預期產物的總質量}{全部反應物的總質量}$×100%=$\frac{44}{28+71+74}$×100%≈25.4%,
故答案為:CH2=CH2+Cl2+Ca(OH)2→ +CaCl2+H2O;25.4%;
+CaCl2+H2O;25.4%;
(4)乙烯在銀作催化劑的作用下反應:2CH2=CH2+O2$\stackrel{Ag}{→}$2 ,該反應通過一步加成反應生成,原子利用率為100%,無污染,
,該反應通過一步加成反應生成,原子利用率為100%,無污染,
故答案為:2CH2=CH2+O2$\stackrel{Ag}{→}$2 ;無污染,原子利用率100%;
;無污染,原子利用率100%;
(5)根據同系物通式的推導法可知,該一系列化合物的通式為C2nH 4n+2On,則碳元素的質量分數為$\frac{2n×12}{2n×12+4n+2+16n}$×100%,n趨向于正無窮時,碳元素質量分數的最大,最大值是$\frac{6}{11}$≈54.54%,
故答案為:B.
點評 本題考查有機物環氧乙烷的幾種制備方法,注意根據給予的信息及有機物結構進行推斷,側重考查學生的分析推理能力,題目難度中等.


 新思維假期作業寒假吉林大學出版社系列答案
新思維假期作業寒假吉林大學出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 提高硫酸亞鐵的溶解度 | B. | 防止硫酸亞鐵分解 | ||
| C. | 抑制硫酸亞鐵水解 | D. | 稀硫酸防止硫酸亞鐵被氧化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
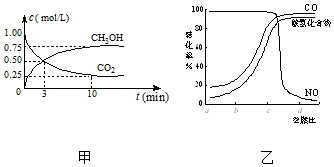 CO2、SO2、NOx是對環境影響較大的氣體,控制和治理CO2、SO2、NOx是解決溫室效應、減少酸雨和光化學煙霧的有效途徑.
CO2、SO2、NOx是對環境影響較大的氣體,控制和治理CO2、SO2、NOx是解決溫室效應、減少酸雨和光化學煙霧的有效途徑.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 編號 | 試劑組 | 結論 |
| ① | NaOH溶液、酚酞試液 | |
| ② | Na2CO3溶液、酚酞試液 | |
| ③ | 碘水、淀粉溶液 | |
| ④ | KMnO4溶液、稀硫酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
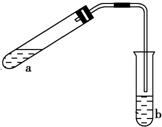 可用如圖所示的裝置制取少量乙酸乙酯(酒精燈等在圖中均已略去).請填空:
可用如圖所示的裝置制取少量乙酸乙酯(酒精燈等在圖中均已略去).請填空:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cl2、SO2均能品紅溶液褪色,說明二者漂白原理相同 | |
| B. | 濃Na2SO4溶液和甲醛都能使蛋白質從溶液中析出,說明二者均使蛋白質發生鹽析 | |
| C. | CO2、SO2使澄清石灰水變渾濁,說明二者均為酸性氧化物 | |
| D. | 溶液中滴加硝酸酸化的Ba(NO3)2溶液出現白色沉淀,說明該溶液中一定有SO42- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com