
| 編號 | 試劑組 | 結論 |
| ① | NaOH溶液、酚酞試液 | |
| ② | Na2CO3溶液、酚酞試液 | |
| ③ | 碘水、淀粉溶液 | |
| ④ | KMnO4溶液、稀硫酸 |
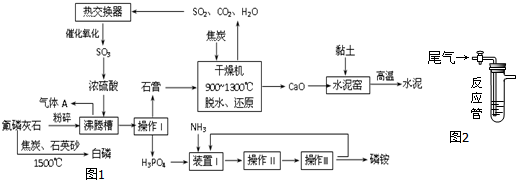
分析 氟磷灰石粉碎富集后,在沸騰槽中用濃硫酸酸化得到硫酸鈣、磷酸和HF氣體,操作Ⅰ過濾分離得到石膏與磷酸.裝置Ⅰ中磷酸與氨氣發生反應,可以生成(NH4)3PO4、(NH4)2HPO4、NH4H2PO4,操作Ⅱ是由溶液中析出晶體,應為蒸發濃縮、冷卻結晶等操作,銨鹽受熱容易分解,在結晶時應采用低溫蒸發結晶.在經過過濾分離得到磷銨,分離得到濾液進行循環利用.石膏在干燥機中脫水、再還原反應得到二氧化碳、二氧化硫、水蒸氣等氣體,氣體處理后在熱交換器中發生催化氧化得到三氧化硫,三氧化硫轉化為硫酸,再循環利用.CaO與黏土等高溫反應得到水泥.
(1)操作Ⅰ是把固體與液體分開,應為過濾;操作Ⅱ是由溶液中析出晶體,應萃取蒸發濃縮、冷卻結晶等操作;
(2)根據在沸騰槽中用濃硫酸酸化氟磷灰石得到硫酸鈣、磷酸和HF氣體分析判斷;
(3)氟磷灰石與焦炭、石英砂混合在電爐中加熱到1500℃發生反應生成白磷、SiF4和CO;
(4)根據原子守恒用氧化物表示石脂(Al2[OH]4Si2O5•nH2O);
(5)移去反應中放出的熱量,使反應后的氣體降溫并預熱未反應的氣體;
(6)SO2、微量的SO3和酸霧都能與氫氧化鈉、碳酸鈉反應,不能測定二氧化硫的含量,利用SO2的還原性采用滴定法測定其含量,可以用氧化劑酸性KMnO4溶液、碘水等氧化,根據方程式進行計算.
解答 解:(1)操作Ⅰ是把固體與液體分開,應為過濾;操作Ⅱ是由溶液中析出晶體,應為蒸發濃縮、冷卻結晶等操作,故答案為:過濾;蒸發濃縮,冷卻結晶;
(2)因為在沸騰槽中用濃硫酸酸化氟磷灰石得到硫酸鈣、磷酸和HF氣體,則反應生成酸性且加熱,鋼鐵易被溶解,反應又產生HF,HF能腐蝕玻璃
,所以沸騰槽選附有聚偏氟乙烯防腐層的石墨,故答案為:附有聚偏氟乙烯防腐層的石墨;因為在酸性且加熱條件下,鋼鐵易被溶解,反應產生HF,HF能腐蝕玻璃;
(3)氟磷灰石與焦炭、石英砂混合在電爐中加熱到1500℃發生反應生成白磷、SiF4和CO,反應方程式為:4Ca5(PO4)3F+21SiO2+30C$\frac{\underline{\;1500℃\;}}{\;}$20CaSiO3+3P4+SiF4↑+30CO↑,故答案為:4Ca5(PO4)3F+21SiO2+30C$\frac{\underline{\;1500℃\;}}{\;}$20CaSiO3+3P4+SiF4↑+30CO↑;
(4)石脂(Al2[OH]4Si2O5•nH2O),根據原子守恒,其用氧化物表示為Al2O3•2SiO2•(n+2)H2O;
故答案為:Al2O3•2SiO2•(n+2)H2O;
(5)催化氧化時使用熱交換器的原因是:移去反應中放出的熱量,使反應后的氣體降溫并預熱未反應的氣體,
故答案為:移去反應中放出的熱量,使反應后的氣體降溫并預熱未反應的氣體;
(6)①NaOH溶液與SO2、微量的SO3和酸霧反應,測量的SO2含量偏高,故不能,故答案為:不能,因為SO2、微量的SO3和酸霧均可以與NaOH溶液反應,測量的SO2含量偏高;
②Na2CO3溶液與SO2、微量的SO3和酸霧反應,測量的SO2含量偏高,故不能,故答案為:不能,因為Na2CO3溶液與SO2、微量的SO3和酸霧反應,測量的SO2含量偏高;
③硫酸尾氣中只有SO2能被碘水氧化,溶液顏色由藍色變為無色,則根據SO2+I2+H2O=2HI+H2SO4,所以SO2的含量為$\frac{0.1×5×10{\;}^{-3}×22.4}{10}$×100%=0.112%,答:硫酸尾氣中SO2的體積分數為0.112%;
④硫酸尾氣中只有SO2能被酸性KMnO4溶液氧化,溶液顏色由紫紅色變為無色,則根據2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4,所以SO2的含量為$\frac{0.1×5×10{\;}^{-3}×\frac{5}{2}×22.4}{10}$×100%=0.28%,答:硫酸尾氣中SO2的體積分數為0.28%.
點評 本題考查制備方案設計工藝流程,涉及物質的分離提純、基本操作、平衡移動原理、物質含量測定等,是對基礎知識的綜合應用,難度中等.


科目:高中化學 來源: 題型:解答題
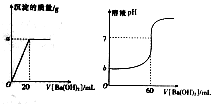 室溫下,某同學為測量硫酸和鹽酸混合溶液中溶質的濃度進行如下實驗:取混合酸20mL放入錐形瓶中,逐滴滴人0.05mol•L-1的Ba(OH)2溶液,實驗記錄如下:(1g3=0.5)
室溫下,某同學為測量硫酸和鹽酸混合溶液中溶質的濃度進行如下實驗:取混合酸20mL放入錐形瓶中,逐滴滴人0.05mol•L-1的Ba(OH)2溶液,實驗記錄如下:(1g3=0.5)查看答案和解析>>
科目:高中化學 來源: 題型:解答題
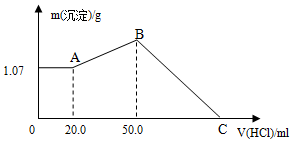 把NaOH、FeCl3、AlCl3三種固體組成的混合物溶于足量水后,產生1.07g白色沉淀,再向所得懸濁液中逐滴加入1mol/L HCl溶液,加入HCl溶液的體積與生成沉淀的關系如圖所示.試回答:
把NaOH、FeCl3、AlCl3三種固體組成的混合物溶于足量水后,產生1.07g白色沉淀,再向所得懸濁液中逐滴加入1mol/L HCl溶液,加入HCl溶液的體積與生成沉淀的關系如圖所示.試回答:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 盛濃鹽酸的分液漏斗可用長頸漏斗代替 | |
| B. | 可在集氣瓶口放一張濕潤的淀粉碘化鉀試紙,觀察氯氣是否收集滿 | |
| C. | 用飽和食鹽水吸收尾氣 | |
| D. | 為了便于學生觀察氯氣的制備實驗,可在講臺上直接做氯氣的制備實驗 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 +CaCl2+H2O,該反應的原子利用率25.4%.
+CaCl2+H2O,該反應的原子利用率25.4%. ,
, )與乙二醇作用,可生成一系列化合物:
)與乙二醇作用,可生成一系列化合物: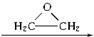 HO-CH2-CH2-O-CH2-CH2-OH
HO-CH2-CH2-O-CH2-CH2-OH
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
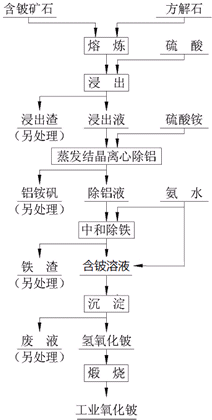 硫酸法是現代氧化鈹或氫氧化鈹生產中廣泛應用的方法之一,其原理是利用預焙燒破壞鈹礦物(綠柱石-3BeO•Al2O3•6SiO2及少量FeO等)的結構與晶型,再采用硫酸酸解含鈹礦物,使鈹、鋁、鐵等酸溶性金屬進入溶液相,與硅等脈石礦物初步分離,然后將含鈹溶液進行凈化、除雜,最終得到合格的氧化鈹( 或氫氧化鈹) 產品,其工藝流程如圖.
硫酸法是現代氧化鈹或氫氧化鈹生產中廣泛應用的方法之一,其原理是利用預焙燒破壞鈹礦物(綠柱石-3BeO•Al2O3•6SiO2及少量FeO等)的結構與晶型,再采用硫酸酸解含鈹礦物,使鈹、鋁、鐵等酸溶性金屬進入溶液相,與硅等脈石礦物初步分離,然后將含鈹溶液進行凈化、除雜,最終得到合格的氧化鈹( 或氫氧化鈹) 產品,其工藝流程如圖.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com