
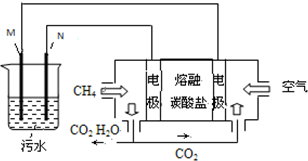
 工業廢水中常含有一定量的Cr2O72-,會對人類及生態系統產生很大損害,電解法是一種行之有效的除去鉻的方法之一.該法用Fe和石墨作電極電解含Cr2O72-的酸性廢水,最終將鉻轉化為Cr(OH)3沉淀,達到凈化目的.某科研小組利用以上方法處理污水,設計了熔融鹽電池和污水電解裝置如圖所示.
工業廢水中常含有一定量的Cr2O72-,會對人類及生態系統產生很大損害,電解法是一種行之有效的除去鉻的方法之一.該法用Fe和石墨作電極電解含Cr2O72-的酸性廢水,最終將鉻轉化為Cr(OH)3沉淀,達到凈化目的.某科研小組利用以上方法處理污水,設計了熔融鹽電池和污水電解裝置如圖所示.分析 (1)實驗原理:用Fe為電極進行電解生成Fe2+,作為還原劑還原Cr2O72-,銅離子不具有還原性;
(2)電解池的陽極上發生失電子的氧化反應,根據電極反應產物結合溶液的環境來回答;
(3)燃料電池中,正極發生的反應一定是氧氣得電子的過程,據此書寫電極反應;
(4)在燃料電池和電解池的串聯電路中,轉移的電子數目是相同的,據電子守恒進行計算.
解答 解:(1)該實驗原理:用Fe為電極進行電解生成Fe2+,作為還原劑還原Cr2O72-,所以金屬鐵是陽極,不能用Cu電極來代替Fe電極,因陽極產生的Cu2+不能還原Cr2O72-,故答案為:M;不能;因陽極產生的Cu2+不能還原Cr2O72-;
(2)電解池的陽極上發生失電子的氧化反應,陽極附近溶液中,發生反應的離子方程式是:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,根據陽離子移向陰極的原理,則陰極附近的沉淀有Cr(OH)3、Fe(OH)3,故答案為:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O;Cr(OH)3、Fe(OH)3;
(3)①料電池中,正極反應一定是氧氣的電子的過程,該電池的電解質環境是熔融碳酸鹽,所以電極反應為:O2+2CO2+4e-=2CO32- (或2O2+4CO2+8e-=4CO32-),故答案為:O2+2CO2+4e-=2CO32- (或2O2+4CO2+8e-=4CO32-);
(4)陰極的電極反應為:2H++2e-=H2↑,陰極產生了4.48L(標準狀況)即2mol的氫氣產生,所以轉移電子的物質的量為0.4mol,根據電池的負極電極反應是CH4+4CO32--8e-=5CO2+2H2O,當轉移0.4mol電子時,消耗CH4(標準狀況)的物質的量是0.05mol,其體積V=nVm=0.05mol×22.4L/mol=1.12L,故答案為:1.12L.
點評 本題綜合考查了化學平衡原理、氧化還原反應、和電化學知識等內容,考查學生分析和解決問題的能力,難度較大.分析時要根據題給信息,結合相關原理進行解答.


科目:高中化學 來源: 題型:解答題
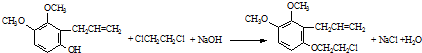 .
.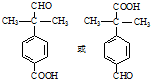 .
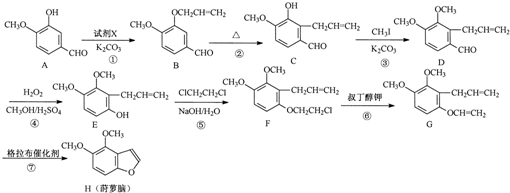
.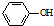 為原料制備
為原料制備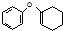 的合成路線流程圖(無機試劑任用).合成路線流程圖示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{濃硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3
的合成路線流程圖(無機試劑任用).合成路線流程圖示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{濃硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化劑 | B. | 還原劑 | C. | 催化劑 | D. | 反應物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分子中鍵能越大,鍵長越長,則分子越穩定 | |
| B. | P4和CH4都是正四面體型結構的分子,且鍵角都為109°28ˊ | |
| C. | 在化學反應中,某元素由化合態變為游離態,則該元素一定被還原 | |
| D. | 電子層結構相同的簡單離子,其半徑隨核電荷數增大而減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | N、P、As的電負性隨原子序數的增大而增大 | |
| B. | 價電子排布為4s24p3的元素位于第四周期第ⅤA族,是p區元素 | |
| C. | 2p和3p軌道形狀均為紡錘形,能量也相等 | |
| D. | 氮原子的最外層電子的軌道表示式: |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
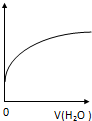
| A. | CH3COO-水解常數 | B. | 溶液中CH3COOH的數目 | ||
| C. | 溶液的PH | D. | 溶液中CH3COO- 的濃度 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | X與Y形成化合物時,X可能顯負價,也可能顯正價 | |
| B. | 第一電離能X可能小于Y | |
| C. | X的最高價含氧酸的酸性強于Y的最高價含氧酸的酸性 | |
| D. | 原子序數X一定大于Y |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com