

分析 (1)①Cu為29號元素,根據電子排布式的書寫方法來解答;
②根據等電子體的結構相似,則O22+中含有三鍵,根據三鍵中有2個π鍵來計算;
③丙烯腈(H2C=CH-C≡N)中的C分別形成2個δ鍵和3個δ鍵,故碳原子的雜化軌道類型為sp和sp2雜化;越易失去一個電子,則第一電離能越大;
(2)利用均攤法計算含1molH3BO3的晶體中的氫鍵;[B(OH)4]-中B原子的價層電子對數分析;
(3)根據價電子排布式判斷出M原子為Cl原子;
①晶胞中含有4個Cu原子,Cl原子位于頂點與面心上,利用均攤法計算得出;
②根據電負性差值判斷化合物類型;
(4)該晶胞中大球個數=12×$\frac{1}{4}$=3,小球個數=8×$\frac{1}{8}$=1,根據其化學式知,小球為N3-、大球為Cu+,N3-的配位數為6,該晶胞棱長=(2a+2b)pm=(2a+2b)×10-10cm,晶胞體積=(2a+2b)3×10-30cm3,晶胞密度=$\frac{m}{V}$.
解答 解:(1)①Cu為29號元素,3d軌道有10個電子,4s軌道有1個電子,Cu原子失去最外層電子形成Cu+,Cu+的基態電子排布式為1s22s22p63s23p63d10,
故答案為:1s22s22p63s23p63d10;
②等電子體的結構相似,則O22+中含有三鍵,所以在1個O22+含有2個π鍵,故1 mol O22+中,含有2NA個π鍵,故答案為:2NA;
③丙烯腈(H2C=CH-C≡N)中的C分別形成2個δ鍵和3個δ鍵,故碳原子的雜化軌道類型為sp和sp2雜化;越易失去一個電子,則第一電離能越大,H2C=CH-C≡N中N元素最難失去電子,則N的第一電離能最大,故答案為:sp、sp2;N;
(2)一個H3BO3分子對應著6個氫鍵,一個氫鍵對應著2個H3BO3分子,因此含有1 molH3BO3分子的晶體中有3mol氫鍵,[B(OH)4]-中B原子形成4個共價鍵,則B原子的價層電子對數為4,為sp3雜化,沒有孤電子對,空間結構為正四面體型;
故答案為:3;正四面體型;
(3)M原子的外圍電子排布式為3S23P5,M原子為Cl原子,則
①由晶胞結構可知,Cu原子處于晶胞內部,晶胞中含有4個Cu原子,Cl原子位于頂點與面心上,晶胞中含有Cl原子數目為8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故化學式為CuCl,
故答案為:CuCl;
②電負性差值大于1.7原子間易形成離子鍵,小于1.7原子間形成共價鍵,銅與X的電負性分別為1.9和3.0,差值為1.1小于1.7,形成共價鍵,
故答案為:共價;
(4)該晶胞中大球個數=12×$\frac{1}{4}$=3,小球個數=8×$\frac{1}{8}$=1,根據其化學式知,小球為N3-、大球為Cu+,N3-的配位數為6,該晶胞棱長=(a+b)pm=(2a+2b)×10-10cm,晶胞體積=(2a+2b)3×10-30cm3,晶胞密度=$\frac{m}{V}$=$\frac{\frac{206}{{N}_{A}}×1}{(2a+2b)^{3}×1{0}^{-30}}$g•cm-3=$\frac{103×1{0}^{-30}}{4(a+b)^{3}{N}_{A}}$g•cm-3,
故答案為:6;$\frac{103×1{0}^{-30}}{4(a+b)^{3}{N}_{A}}$.
點評 本題考查較為綜合,題目難度中等,涉及電子排布式、第一電離能、晶胞的計算、雜化類型的判斷、氫鍵等知識點,對學生的空間想象有一定要求,側重考查學生對知識的遷移應用,注意信息的理解和綜合應用.


科目:高中化學 來源: 題型:解答題
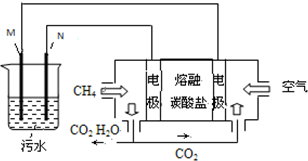 工業廢水中常含有一定量的Cr2O72-,會對人類及生態系統產生很大損害,電解法是一種行之有效的除去鉻的方法之一.該法用Fe和石墨作電極電解含Cr2O72-的酸性廢水,最終將鉻轉化為Cr(OH)3沉淀,達到凈化目的.某科研小組利用以上方法處理污水,設計了熔融鹽電池和污水電解裝置如圖所示.
工業廢水中常含有一定量的Cr2O72-,會對人類及生態系統產生很大損害,電解法是一種行之有效的除去鉻的方法之一.該法用Fe和石墨作電極電解含Cr2O72-的酸性廢水,最終將鉻轉化為Cr(OH)3沉淀,達到凈化目的.某科研小組利用以上方法處理污水,設計了熔融鹽電池和污水電解裝置如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
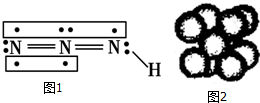 疊氮化物是一類重要化合物,氫疊氮酸(HN3)是一種弱酸,如圖為分子結構示意圖1.肼(N2H4)被亞硝酸氧化時便可生成氫疊氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性類似于醋酸,可微弱電離出H+和N3-.
疊氮化物是一類重要化合物,氫疊氮酸(HN3)是一種弱酸,如圖為分子結構示意圖1.肼(N2H4)被亞硝酸氧化時便可生成氫疊氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性類似于醋酸,可微弱電離出H+和N3-. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2O、Na2O2組成元素相同,均與H2O反應,均屬于堿性氧化物 | |
| B. | 新制氯水顯酸性,向其中滴加少量紫色石蕊試液,充分振蕩后溶液呈無色 | |
| C. | NO、SO2、NO2都是大氣污染氣體,在空氣中都不能穩定存在 | |
| D. | SiO2是酸性氧化物,能與NaOH溶液反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
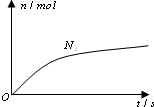 某離子反應中涉及H2O、ClO-、NH4+、H+、N2、Cl-六種微粒.其中N2的物質的量隨時間變化的曲線如右圖所示.則下列判斷正確的是( )
某離子反應中涉及H2O、ClO-、NH4+、H+、N2、Cl-六種微粒.其中N2的物質的量隨時間變化的曲線如右圖所示.則下列判斷正確的是( )| A. | 反應后溶液的酸性明顯增強 | |
| B. | 消耗1 mol還原劑,轉移6 mol電子 | |
| C. | 氧化劑與還原劑的物質的量之比為2:3 | |
| D. | 該反應的還原劑是Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 不純物質 | 除雜試劑 | 分離方法 | |
| A | 乙酸乙酯(乙酸) | 飽和碳酸鈉溶液 | 過濾 |
| B | 乙烷(乙烯) | 酸性高錳酸鉀溶液 | 洗氣 |
| C | 苯(Br2) | KOH溶液 | 分液 |
| D | 苯(苯酚) | 濃溴水 | 過濾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某些花崗石產生氡(${\;}_{86}^{222}$Rn),從而對人體產生傷害,${\;}_{86}^{222}$Rn的質量數是222 | |
| B. | Se是人體必需的微量元素,${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互為同位素,是兩種不同的核素 | |
| C. | ${\;}_{92}^{235}$U的濃縮一直被國際社會關注,其中子數和質子數之差為51 | |
| D. | 113號元素屬于過渡元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③⑤ | B. | ②④ | C. | ①③ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
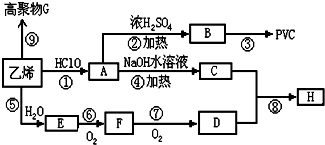
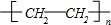 ;
;查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com