
| A. | CH3CH3中的兩個碳原子與BF3中的硼原子均采取sp2雜化 | |
| B. | 晶體硅和石英晶體中的硅原子均采取sp3雜化 | |
| C. | BeCl2中的鈹原子和H2O中的氧原子均采取sp雜化 | |
| D. | CO2中的碳原子與CH2=CH2中的兩個碳原子均采取sp雜化 |
分析 根據價層電子對互斥理論確定中心原子雜化類型,價層電子對個數=σ鍵個數+孤電子對個數,σ鍵個數=配原子個數,孤電子對個數=$\frac{1}{2}$(a-xb),a指中心原子價電子個數,x指配原子個數,b指配原子形成穩定結構需要的電子個數.中心原子的雜化類型為sp3,說明該分子中心原子的價層電子對個數是4,sp2雜化,說明該分子中心原子的價層電子對個數是3,sp雜化,說明該分子中心原子的價層電子對個數是2,據此判斷.
解答 解:A.CH3CH3分子中C原子價層電子對個數=4+$\frac{1}{2}$×(4-4×1)=4,為sp3雜化,BF3分子中硼原子價層電子對個數=3+$\frac{1}{2}$×(3-3×1)=3,所以采取sp2雜化,故A錯誤;
B.晶體硅中的硅原子平均每個硅原子與四個鄰近硅原子生成四個共價鍵,形成4個σ鍵,無孤電子對,硅原子雜化軌道數=σ鍵數+孤對電子對數=4+0=4,所以采取sp3雜化,石英晶體成分為二氧化硅,是原子晶體,硅原子通過Si-O共價鍵形成4個σ鍵,無孤電子對,硅原子雜化軌道數=σ鍵數+孤對電子對數=4+0=4,硅原子采取sp3雜化,故B正確;
C.BeCl2中價層電子對個數=σ鍵個數+孤電子對個數=2+$\frac{1}{2}$×(2-2×1)=2,中心原子是以sp雜化,H2O中O原子的價層電子對個數=2+$\frac{1}{2}$(6-2×1)=4,所以O原子采用sp3雜化,故C錯誤;
D.二氧化碳分子中價層電子對個數=σ鍵個數+孤電子對個數=2+$\frac{1}{2}$(4-2×2)=2,采取sp雜化方式,C2H4分子中每個碳原子價層電子對個數=σ鍵個數+孤電子對個數=3+$\frac{1}{2}$(4-2×2)=3,所以采取sp2雜化,故D錯誤;
故選B.
點評 本題考查了原子雜化方式的判斷,根據價層電子對互斥理論來分析解答即可,明確價層電子對個數=σ鍵個數+孤電子對個數,σ鍵個數=配原子個數,孤電子對個數=$\frac{1}{2}$(a-xb)中各個字母的含義是解本題的關鍵,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 升高溫度 | B. | 分離出HI | C. | 充入H2 | D. | 充入He |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
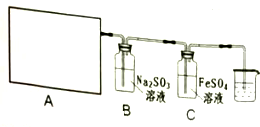
| 實驗目的 | 操作與結論 |
| ①FeSO4溶液完全未被氧化 | 實驗①取少許溶液于試管中,滴入數滴KSCN溶液,若溶液不變色(選填“不變色”或“變紅色”),說明溶液完全未被氧化. |
| ②FeSO4部分被氧化 | ②實驗②:取少許溶液于試管中,滴入數滴酸性KMnO4溶液,若溶液褪色;再另取少許溶液于試管中,滴加幾滴KSCN溶液,溶液變 紅(血紅)色,說明溶液被部分氧化. |
| ③FeSO4完全被氧化 | ③重復實驗②在待測②液中滴加數滴酸性KMnO4溶液后,溶液不褪色,另一實驗現象與②同. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
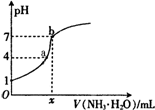 向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,測得溶液的pH隨加入氨水的體積變化如圖所示.下列判斷正確的是( )
向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,測得溶液的pH隨加入氨水的體積變化如圖所示.下列判斷正確的是( )| A. | x=20 | B. | 稀H2SO4的濃度為0.10mol/L | ||
| C. | b點有:2c(NH4+)=c(SO42-)>c(H+)=c(OH-) | D. | a點有:c(NH4+)<2c(SO42-) |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
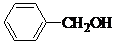 、
、 、
、 、
、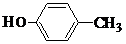 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
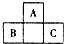 如圖所示是元素周期表中短周期的一部分,已知B原子與C原子核外電子總數為A原子核外電子總數的4倍,則下列推斷正確的是( )
如圖所示是元素周期表中短周期的一部分,已知B原子與C原子核外電子總數為A原子核外電子總數的4倍,則下列推斷正確的是( )| A. | A、B、C三者均為非金屬元素 | B. | B與C只能形成一種共價化合物 | ||
| C. | A與B、A與C均可形成離子化合物 | D. | A、B、C三者最外層電子數之和為40 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com