
分析 (1)氯氣和氫氧化鈉溶液反應生成氯化鈉,氯酸鈉和水,結合原子守恒和氧化還原反應電子守恒配平書寫化學方程式;
(2)利用物質溶解度的不同析出晶體;
(3)氯化鈉溶解度隨溫度變化不大,氯酸鉀溶解度隨溫度變化大,可以通過蒸發濃縮,冷卻結晶的方法得到溶質晶體;
(4)標注元素化合價變化,元素化合價升高的做還原劑被氧化,元素化合價降低的做氧化劑被還原,結合電子轉移總數和氧化還原反應定量關系計算得到.
解答 解:(1)氯氣和氫氧化鈉溶液反應生成氯化鈉,氯酸鈉和水,結合原子守恒和氧化還原反應電子守恒配平書寫化學方程式為:3Cl2+6NaOH=5NaCl+NaClO3+3H2O,
故答案為:3Cl2+6NaOH=5NaCl+NaClO3+3H2O;
(2)利用物質溶解度的不同析出晶體,NaClO3溶液與KC1能發生復分解反應的原因是KCl03溶解度較小,
故選:C;
(3)氯化鈉溶解度隨溫度變化不大,氯酸鉀溶解度隨溫度變化大,可以通過蒸發濃縮,冷卻結晶、過濾洗滌,干燥的方法得到溶質晶體,
故答案為:蒸發濃縮;冷卻結晶;
(4)標注元素化合價變化,元素化合價升高的做還原劑被氧化,元素化合價降低的做氧化劑被還原,8KClO3+24HCl=8KCl+9Cl2↑+6ClO2↑+12H2O,反應中氯元素化合價+5價變化為+4價和0價,-1價氯元素變化為0價,電子轉移總數為16e-,還原產物為Cl2、ClO2,氧化產物為Cl2,結合電子轉移總數和氧化還原反應定量關系計算得到,8molKClO3被還原電子轉移16mol,如有lmol KClO3被還原,轉移的電子數目為2NA,如有1mol HC1被氧化,轉移的電子數目為NA,
故答案為:Cl2、ClO2;2NA;NA.
點評 本題考查了氧化還原反應電子轉移總數計算,產物分析判斷物質分離方法的應用,掌握基礎是關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電子式:次氯酸: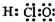 ;過氧化鈉: ;過氧化鈉: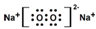 ;羥基: ;羥基: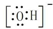 | |
| B. | KHSO4熔融電離:KHSO4=K++H++SO42-;KHCO3溶解于水:KHCO3=K++H++CO32- | |
| C. | 高聚物化學式:聚異戊二烯: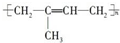 ;PVC: ;PVC: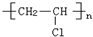 ;PE: ;PE: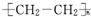 | |
| D. | 下列分子式代表的有機物均有可能與NaHCO3反應放出CO2:C5H12O2、C2H4O2、C7H8O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某物質的溶液pH<7,則該物質一定是酸或強酸弱堿鹽 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 25℃時,用pH試紙測定出某醋酸溶液的pH=3.50 | |
| D. | 常溫時,某溶液中由水電離出來的c(H+)和c(OH-)的乘積為1×10-24,該溶液中一定可以大量存在:K+、Na+、AlO2-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在氧化還原反應中,甲原子失去的電子比乙原子失去的電子多 | |
| B. | 同價態的陽離子,甲比乙的氧化性弱 | |
| C. | 甲不能跟稀鹽酸反應放出氫氣而乙能 | |
| D. | 將甲、乙作電極組成原電池時,甲是正極 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 序號 | I1 | I2 | I3 | I4 | I5 | I6 | I7 | |
| A的電離能 | 1402 | 2856 | 4578 | 7475 | 9445 | 53267 | … | |
| B的電離能 | 1012 | 1907 | 2914 | 4964 | 6274 | 21267 | 25431 | |
| 序號 | I8 | I9 | I10 | I11 | I12 | I13 | I14 | … |
| B的電離能 | 29872 | 35905 | 40950 | 46261 | 54110 | 59024 | 271791 | … |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com