

| 2min | 4min | 6min | 8min | ′′′ | |
| CO | 0.07 | 0.06 | 0.04 | 0.05 | ′′′ |
| H2 | x | 0.12 | 0.12 | 0.2 | ′′′ |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | ′′′ |
分析 (1)①據已化學方程式,根據蓋斯定律計算;
②該反應是放熱反應,反應物總能量大于生成物總能量,物質越穩定,其能量越小;
③利用三段式法計算平衡狀態時各物質的平衡濃度;
(2)①根據表中2min和4min時各種物質的濃度的變化量,依據轉化量之比等于方程式計量系數之比可求出x值;
②該反應的平衡常數表達式K=$\frac{[C{H}_{3}OH]}{[CO][{H}_{2}]^{2}}$,將在250℃下,將4min時各物質平衡濃度帶入計算;
③根據6min到8min時各物質濃度的變化來確定改變條件;
④求出第8min時反應的濃度商Qc,與250℃時K做比較,若Qc=K反應達到平衡狀態;
⑤反應條件的選擇既要考慮限度又要考慮速率,二者應兼顧;
(3)根據算的電離平衡常數表達式甲酸的平衡常數K=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(HCOOH)}$代入數據計算氫離子濃度;結合弱電解質的電離、鹽的水解原理的應用來比較離子濃度大小.
解答 解:(1)①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol①
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol②
將方程式3①-②得CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=3×(-242kJ/mol)-(-676kJ/mol)=-50 kJ/mol,
故答案為:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol;
②該反應是放熱反應,反應物總能量大于生成物總能量,物質越穩定,其能量越小,所以液態物質的能量小于氣態物質,則符合條件的圖象是a,故選a;
③H2O(g)+CO(g)=H2(g)+CO2(g)
起始量(mol/L) 2 1 0 0
轉化量(mol/L) x x x x
平衡量(mol/L)2-x 1-x x x
$\frac{{x}^{2}}{(2-x)•(1-x)}$=1,x=$\frac{2}{3}$,所以水的轉化率為:$\frac{\frac{2}{3}}{2}$×100%=33.3%,
故答案為:33.3%;
(2)①從圖中可知從2min到4min時各物質的轉化量為:△C(CO):△C(H2):△C(CH3OH)=(0.07-0.06):(X-0.12):(0.04-0.03)
化學反應中各物質的轉化量之比等于方程式的計量系數得:(0.07-0.06):(X-0.12):(0.04-0.03)=1:2:1,解得X=0.14,
250℃下,甲醇的平衡濃度是0.04mol/L,氫氣的平衡濃度是0.12mol/L,一氧化碳的平衡濃度是0.04mol/L所以平衡常數K=$\frac{[C{H}_{3}OH]}{[CO][{H}_{2}]^{2}}$=$\frac{0.04}{0.06×0.12×0.12}$=46.3;
故答案為:0.14;46.3;
②對比6min和8min時各物質的濃度可知改變條件后反應反應向正方向進行,按照轉化量之比等于計量系數之比△C(CO):△C(H2):△C(CH3OH)=0.01mol/L:0.02mol/L:0.01mol/L,所以8min后三種物質的濃度應為:(0.06-0.01)mol/L、(0.12-0.02)mol/L、(0.04+0.01)mol/L,而8min后氫氣的濃度為0.2mol/L,所以多加了0.1mol/L×10=1mol的氫氣;
第8min時反應的濃度商Qc=$\frac{0.05}{0.05×0.2×0.2}$=$\frac{1}{0.04}$≠K,所以此時不是平衡狀態,
故答案為:增加了1 mol氫氣;不是;
③從反應限度角度考慮:該反應而該反應為放熱反應,溫度過高,轉化率降低;從速率角度考慮:溫度低,反應速率慢,單位時間內的產量低,為提高經濟效應,反應速率和限度應兼顧,所以選擇溫度一般控制在240~270℃;
故答案為:溫度低,反應速率慢,單位時間內的產量低;而該反應為放熱反應,溫度過高,轉化率降低;
(3)甲酸的平衡常數K=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(HCOOH)}$=1×10-4,所得溶液的c(HCOOH)=c(HCOO-),此時c(H+)=1×10-4,所以pH=4,溶液呈酸性,得到的是甲酸和甲酸鈉的混合物,溶液中各離子濃度大小關系為:c(HCOO-)>c(Na+)>c(H+)>c(OH-).
故答案為:4;c(HCOO-)>c(Na+)>c(H+)>c(OH-).
點評 本題考查了蓋斯定律的應用、轉化率計算、化學平衡常數的計算、平衡狀態的判斷、鹽類水解,考察范圍廣,題目跨度大,難度一般.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
| 實驗序號 | 銀氨溶液 | 乙醛的量/滴 | 水浴溫度/℃ | 反應混合液的pH | 出現銀鏡時間 |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
| 4 | 1 | 3 | 30 | 11 | 9 |
| 5 | 1 | 3 | 50 | 11 | 6 |
| 6 | 1 | 5 | 80 | 11 | 3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
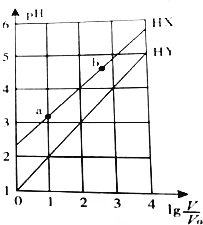
| A. | HX、HY都是弱酸,且HX的酸性比HY的弱 | |
| B. | 常溫下,由水電離出的c(H+)•c(OH-):a<b | |
| C. | 相同溫度下,電離常數K( HX):a>b | |
| D. | lg$\frac{V}{{V}_{0}}$=3,若同時微熱兩種溶液(不考慮HX、HY和H2O的揮發),則$\frac{c({X}^{-})}{c({Y}^{-})}$減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 14.4 g | B. | 11.6 g | C. | 8.8 g | D. | 3.2 g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;
; | 第一次 | 第二次 | 第三次 | 第四次 |
| 體積(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
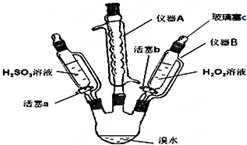 為了探究H2O2、H2SO3和Br2氧化性的相對強弱,設計如下實驗(夾持儀器已略去).請回答下列問題:
為了探究H2O2、H2SO3和Br2氧化性的相對強弱,設計如下實驗(夾持儀器已略去).請回答下列問題:| 步驟 | 實驗操作 | 實驗現象 | 實驗結論 |
| Ⅰ | 打開活塞a,逐滴加入H2SO3溶液至過量 | 橙黃色褪去 | Br2的氧化性大于H2SO3 |
| Ⅱ | 向步驟Ⅰ所得溶液中逐滴加入H2O2溶液 | 剛開始溶液顏色無明顯變化,繼續滴加,溶液變為橙黃色 | H2O2的氧化性大于Br2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com