
 ;
; | 第一次 | 第二次 | 第三次 | 第四次 |
| 體積(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
分析 (1)過氧化氫是共價化合物,氧原子最外層6個電子氧原子和氫原子形成一個共價鍵,氧原子和氧原子間形成一個共價鍵;
(2)實驗室中用過氧化氫制取氧氣生成水和氧氣,依據化學方程式定量關系計算;
(3)H2O2為二元弱酸分步電離;
(4)①酸性高錳酸鉀標準溶液滴定某試樣中過氧化氫的含量,過氧化氫被高錳酸鉀溶液氧化為氧氣,過氧化氫做還原劑;
②滴定前雙氧水溶液顏色是無色,終點時高錳酸鉀稍過量,溶液呈淺紫色;
③第一次滴定體積和其它三次差距過大,應該舍去,求出第二、三、四三次的平均值,根據反應求出過氧化氫的濃度;
④滴定前有氣泡,消耗的高錳酸鉀偏多,測定結果偏高;
(5)如是酸堿中和,可在褪色后再加入堿,觀察溶液是否變紅;
解答 解:(1)過氧化氫是共價化合物,分子中形成的化學鍵是:氧原子和氫原子間形成極性共價鍵,氧原子和氧原子間形成非極性共價鍵,過氧化氫為共價化合物,據此書寫電子式為: ,故答案為:
,故答案為: ;
;
(2)實驗室中用過氧化氫制取氧氣的化學方程式為2H2O2$\frac{\underline{\;催化劑\;}}{\;}$2H2O+O2↑,當生成標準狀況下2.24LO2時,氧氣物質的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,生成1mol氧氣電子轉移2mole-,生成0.1mol氧氣電子轉移為0.2mol,
故答案為:2H2O2$\frac{\underline{\;催化劑\;}}{\;}$2H2O+O2↑,0.2;
(3)H2O2為二元弱酸,其酸性比碳酸弱,水溶液中分步電離,電離方程式為:H2O2?HO2-+H+,HO2-?H++O22-,
故答案為:H2O2?HO2-+H+,HO2-?H++O22-;
(4)①酸性高錳酸鉀標準溶液滴定某試樣中過氧化氫的含量,過氧化氫被高錳酸鉀溶液氧化為氧氣,過氧化氫做還原劑,故答案為:氧化;
②滴定到達終點的現象是,錐形瓶內溶液顏色恰好由無色變為淺紫色,且30秒內溶液不褪色,
故答案為:錐形瓶內溶液顏色恰好由無色變為淺紫色,且30秒內溶液不褪色;
③由于第一次數據誤差過大,故舍去;其它三組的平均值為 18.00ml,根據反應2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2,n(H2O2)=2.5×n(MnO4-)=2.5×0.1000mol•L-1×0.018L,c(H2O2)=$\frac{2.5×0.1×0.018}{0.025}$=0.1800 mol/L,故答案為:0.1800;
④滴定前尖嘴中有氣泡,導致消耗的標準液偏大,測定結果偏高,故答案為:偏高;
(5)如是酸堿中和,可在褪色后再加入堿,觀察溶液是否變紅,若變紅,則甲同學的觀點正確;若未出現紅色,則乙同學的觀點正確,
故答案為:在褪色后的溶液中,加入適量的NaOH溶液,若又出現紅色,則甲同學的觀點正確;若未出現紅色,則乙同學的觀點正確.
點評 本題考查了不同方式比較反應速度的快慢以及過氧化氫的性質等,側重于學生的分析能力和實驗能力的考查,注意根據物質的性質設計實驗方案,難度中等.


 名師點撥卷系列答案
名師點撥卷系列答案 英才計劃期末調研系列答案
英才計劃期末調研系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaHS03溶液顯酸性:HS03-═H++S032- | |
| B. | 苯酚鈉溶液中通入少量C02: C6H50+CO2+H20→C6H50H+HCO3- | |
| C. | 強堿性溶液中次氯酸鈉溶液與Fe(OH)3反應生成Na2FeO4:3ClO-+2Fe(OH)3═2Fe042-+3Cl-+H20+4H+ | |
| D. | 向 Ca(Cl0)2 溶液中通入過量 S02:Ca2++2C10-+SO2═CaSO4↓+2Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 2min | 4min | 6min | 8min | ′′′ | |
| CO | 0.07 | 0.06 | 0.04 | 0.05 | ′′′ |
| H2 | x | 0.12 | 0.12 | 0.2 | ′′′ |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | ′′′ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
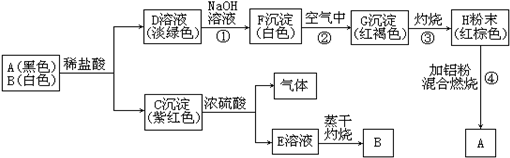
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
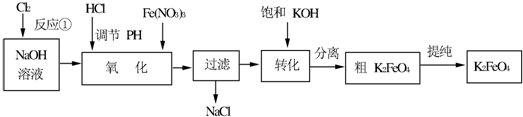

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2SO4 KNO3 Na2CO3 NH4Cl | B. | H2SO4 BaCl2 Na2SO4 NaOH | ||
| C. | MgCl2 AgNO3 KNO3 HCl | D. | NH4HCO3 NaOH NaCl HCl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙醇難溶于水 | B. | 乙烯可使酸性KMnO4溶液褪色 | ||
| C. | 乙酸的酸性比碳酸弱 | D. | 苯不能萃取碘水中的碘單質 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com