
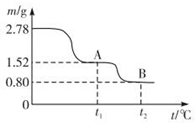
 在中國古代,煉丹家以綠礬(FeSO4•7H2O為原料,放在煉丹爐中鍛燒可制得綠礬油.綠礬油是一種無色粘稠液體,可用于除掉兵器上的鐵銹.如圖是2.78g綠礬隔絕空氣受熱分解時,所得固體產物的質量隨溫度變化的曲線.將加熱產生的所有氣體通入足量的BaCl2溶液.得自色沉淀1.16g.
在中國古代,煉丹家以綠礬(FeSO4•7H2O為原料,放在煉丹爐中鍛燒可制得綠礬油.綠礬油是一種無色粘稠液體,可用于除掉兵器上的鐵銹.如圖是2.78g綠礬隔絕空氣受熱分解時,所得固體產物的質量隨溫度變化的曲線.將加熱產生的所有氣體通入足量的BaCl2溶液.得自色沉淀1.16g.
分析 (1)根據元素守恒,及綠礬油是一種無色粘稠液體,可用于除掉兵器上的鐵銹即能與氧化鐵反應,可知綠礬油應為濃硫酸;2.78g的FeSO4•7H2O晶體的物質的量 $\frac{2.78g}{278g/mol}$=0.01mol,加熱生成FeSO4時的質量為1.52g,再將FeSO4加熱產生的所有氣體通入足量的BaCl2溶液,得自色沉淀應為硫酸鋇1.16g,即0.005mol,則說明產生三氧化硫為0.005mol,其質量為0.4g,得到鐵的氧化物為0.8g,結合鐵元素為0.01mol可知,該氧化物為Fe2O3,根據質量守恒可知,加熱還產生二氧化硫的質量為1.52g-0.8g-0.4g=0.32g,即為0.005mol,據此答題;
(2)化學變化前后元素質量不變,2.88g草酸亞鐵(FeC2O4)中鐵元素的質量與1.44g鐵的氧化物中鐵元素的質量相等,由此可計算出鐵的氧化物中鐵與氧兩元素的質量比,再由質量比計算出原子個數比而確定物質的化學式.
(3)①根據配制一定物質的是濃度溶液的操作所需儀器答題;
②分離固體和液體通常用過濾的方法,過濾所得固體表面有可溶性雜質,通過洗滌除去;
③酸性高錳酸鉀溶液能將亞鐵離子氧化成鐵離子,根據電子得失守恒有5 FeSO4•7H2O~KMnO4,根據高錳酸鉀的物質的量可計算得FeSO4•7H2O的質量,根據$\frac{硫酸亞鐵晶體的質量}{樣品的質量}$×100%計算質量分數.
解答 解:(1)根據元素守恒,及綠礬油是一種無色粘稠液體,可用于除掉兵器上的鐵銹即能與氧化鐵反應,可知綠礬油應為濃硫酸;2.78g的FeSO4•7H2O晶體的物質的量 $\frac{2.78g}{278g/mol}$=0.01mol,加熱生成FeSO4時的質量為1.52g,再將FeSO4加熱產生的所有氣體通入足量的BaCl2溶液,得自色沉淀應為硫酸鋇1.16g,即0.005mol,則說明產生三氧化硫為0.005mol,其質量為0.4g,得到鐵的氧化物為0.8g,結合鐵元素為0.01mol可知,該氧化物為Fe2O3,根據質量守恒可知,加熱還產生二氧化硫的質量為1.52g-0.8g-0.4g=0.32g,即為0.005mol,所以發生反應的化學方程式為2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO3↑+SO2 ↑,
故答案為:濃硫酸;2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO3↑+SO2 ↑;
(2)2.88gFeC2O4中鐵元素的質量=2.88g×$\frac{56}{56+12×2+16×4}$=1.12g,
鐵的氧化物中鐵與氧兩元素的質量比=1.12g:(1.44g-1.12g)=56:16,
鐵的氧化物中鐵與氧兩元素的原子個數比=$\frac{56g}{56g/mol}$:$\frac{16g}{16g/mol}$=1:1,則該鐵的氧化物是FeO,
故答案為:FeO;
(3)①根據配制一定物質的是濃度溶液的操作所需儀器可知,用濃硫酸配制一定物質的量濃度的稀硫酸,所用的儀器有量筒、燒杯、玻璃捧、膠頭滴管及100mL容量瓶,
故答案為:100mL容量瓶;
②分離固體和液體通常用過濾的方法,過濾所得固體表面有可溶性雜質,通過洗滌除去,所以操作A為過濾、洗滌,
故答案為:過濾、洗滌;
③酸性高錳酸鉀溶液能將亞鐵離子氧化成鐵離子,反應的離子方程式為5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,根據電子得失守恒有
5 FeSO4•7H2O~KMnO4,
5×278g 1mol
m(FeSO4•7H2O) 0.2000mol/L×0.02L
所以(FeSO4•7H2O)=0.2000mol/L×0.02L×278g=5.56g,所以樣品中FeSO4•7H2O的質量分數為$\frac{5.56g}{6g}$×100%=93%,
故答案為:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;93%.
點評 本題考查化學方程式的計算,側重于學生的分析能力和計算能力的考查,為高頻考點,注意把握物質的質量的變化關系,能讀懂圖象,從質量守恒的角度解答該題,難度較大.


科目:高中化學 來源: 題型:解答題
 能源問題日益成為制約國際社會經濟發展的瓶頸,越來越多的國家開始實行“陽光計劃”,開發太陽能資源,尋求經濟發展的新動力.
能源問題日益成為制約國際社會經濟發展的瓶頸,越來越多的國家開始實行“陽光計劃”,開發太陽能資源,尋求經濟發展的新動力.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | BaSO3與BaSO4沉淀 | B. | BaSO3沉淀 | ||
| C. | BaSO4沉淀 | D. | 無法得到沉淀物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 6mol | B. | 5mol | C. | 4mol | D. | 2mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cu(OH)2+HCl;Cu(OH)2+CH3COOH | B. | NaHSO4+NaOH;H2SO4+NaOH | ||
| C. | NaHCO3+H2SO4;Na2CO3+HCl | D. | BaCl2與Na2SO4;Ba(OH)2與CuSO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
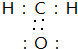
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
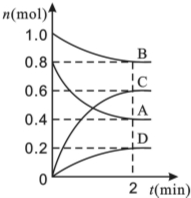 T℃時,在容積為0.5L的密閉容器中發生某一反應,且測得不同時間容器中四種物質A、B、C、D的物質的量變化如圖所示,已知:物質A、B、C均為氣態,D為固態,正反應時吸熱反應,根據要求回答下列問題:
T℃時,在容積為0.5L的密閉容器中發生某一反應,且測得不同時間容器中四種物質A、B、C、D的物質的量變化如圖所示,已知:物質A、B、C均為氣態,D為固態,正反應時吸熱反應,根據要求回答下列問題:查看答案和解析>>
科目:高中化學 來源:2016-2017學年河南省高二上第一次月考化學卷(解析版) 題型:選擇題
用惰性電極電解物質的量濃度相同、體積比為3∶1的CuSO4溶液和NaCl溶液的混合溶液,不可能發生的反應是
A.2Cu2++2H2O 2Cu+4H++O2↑
2Cu+4H++O2↑
B.Cu2++2Cl- Cu+Cl2↑
Cu+Cl2↑
C.2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.2H2O 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com