
 某銨態氮肥由W、X、Y、Z 4種短周期元素組成,其中W的原子半徑最小.
某銨態氮肥由W、X、Y、Z 4種短周期元素組成,其中W的原子半徑最小. ;
; ;
;分析 某銨態氮肥由W、X、Y、Z等4種短周期元素組成,該銨鹽中一定含有N、H元素,且W的原子半徑最小,則W為H元素.
Ⅰ.若Y、Z同主族,ZY2是形成酸雨的主要物質之一,則ZY2為SO2,Y為O、Z為S元素,故X為N元素:
(1)X、Y、Z分別為N、O、S元素,分別處于第二周期ⅤA族、第二周期ⅥA族、第三周期ⅥA族;
(2)①N2H4分子中N原子之間形成1對共用電子對,N原子與H原子之間形成1對共用電子對;
②NH5為NH4H,由銨根離子與氫負離子構成;
③發生反應:4NH3+3O2═2N2+6H2O,計算4mol氨氣反應放出的熱量,注明物質聚集狀態與反應熱,書寫熱化學方程式;
Ⅱ.若Z是形成化合物種類最多的元素,則Z為C元素:
(4)該氮肥為碳酸銨或碳酸氫銨;
(5)a點時兩種物質恰好完全反應,則c(HR)=$\frac{0.02L×0.25mol/L}{0.025L}$=0.2 mol/L,而HR溶液的pH=3,則HR為弱酸,NaR為強堿弱酸鹽,溶液呈堿性,結合電荷守恒可知:c(R-)+c(OH-)-c(H+)=c(Na+);
②0.2 mol/L HR溶液中c(H+)=1.0×10-3mol/L,溶液中c(R-)≈c(H+),c(HR)≈0.2mol/L,代入電離常數Ka=$\frac{c({H}^{+})•c({R}^{-})}{c(HR)}$計算.
解答 解:某銨態氮肥由W、X、Y、Z等4種短周期元素組成,該銨鹽中一定含有N、H元素,且W的原子半徑最小,則W為H元素.
Ⅰ.若Y、Z同主族,ZY2是形成酸雨的主要物質之一,則ZY2為SO2,Y為O、Z為S元素,故X為N元素;
(1)X、Y、Z分別為N、O、S元素,分別處于第二周期ⅤA族、第二周期ⅥA族、第三周期ⅥA族,在周期表位置為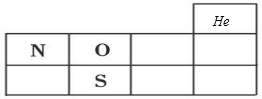 ,
,
故答案為: ;
;
(2)①N2H4分子中N原子之間形成1對共用電子對,N原子與H原子之間形成1對共用電子對,結構式為: ,故答案為:
,故答案為: ;
;
②NH5為NH4H,由銨根離子與氫負離子構成,電子式為 ,故答案為:
,故答案為: ;
;
③發生反應:4NH3+3O2═2N2+6H2O,4mol氨氣反應放出的熱量為382.8kJ×4=1531.2kJ,反應熱化學方程式為:4NH3(g)+3O2(g)═2N2(g)+6H2O(l)△H=-1531.2 kJ•mol-1 ,
故答案為:4NH3(g)+3O2(g)═2N2(g)+6H2O(l)△H=-1531.2 kJ•mol-1 ;
Ⅱ.若Z是形成化合物種類最多的元素,則Z為C元素:
(4)該氮肥為碳酸銨或碳酸氫銨,故答案為:碳酸銨或碳酸氫銨;
(5)a點時兩種物質恰好完全反應,則c(HR)=$\frac{0.02L×0.25mol/L}{0.025L}$=0.2 mol/L,而HR溶液的pH=3,則HR為弱酸,NaR為強堿弱酸鹽,R-離子水解,溶液呈堿性,則pH>7,則c(Na+)>c(R-),水解程度微溶,溶液中離子濃度為:c(Na+)>c(R-)>c(OH-)>c(H+),結合電荷守恒可知:c(R-)+c(OH-)-c(H+)=c(Na+)=$\frac{0.02L×0.25mol/L}{0.045L}$≈0.11mol•L-1,故ab錯誤、c正確,
故答案為:>;c;
②0.2 mol/L HR溶液中c(H+)=1.0×10-3mol/L,溶液中c(R-)≈c(H+)=1.0×10-3mol/L,c(HR)≈0.2mol/L,電離常數Ka=$\frac{c({H}^{+})•c({R}^{-})}{c(HR)}$=$\frac{1×1{0}^{-3}×1×1{0}^{-3}}{0.2}$=5.0×10-6,
故答案為:5.0×10-6.
點評 本題屬于拼合型題目,涉及元素推斷、電子式、結構式、熱化學方程式、鹽類水解、電離平衡常數等,試題知識點較多、綜合性較強,側重考查考生對基本概念和基本原理的理解和應用能力,難度中等.


科目:高中化學 來源: 題型:解答題
| 時間/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 氫氣體積/mL | 0 | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可逆反應達到化學平衡狀態時,正、逆反應速率均等于零 | |
| B. | 當反應物與生成物濃度相等時,可逆反應一定已達到化學平衡狀態 | |
| C. | 用鋅粉代替鋅粒與等濃度的稀硫酸反應,生成氫氣的速率加快 | |
| D. | Fe與稀硫酸反應制取氫氣時,改用濃硫酸可以增大反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
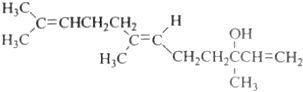
| A. | 橙花醇的分子式C15H26O | |
| B. | 橙花醇在濃硫酸催化下加熱脫水,可以生成不止一種四烯烴 | |
| C. | 橙花醇既能發生取代反應,也能發生加成反應和氧化反應 | |
| D. | 1mol 橙花醇在室溫下與溴的四氯化碳溶液反應,最多消耗240g溴 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將①與②分別稀釋相同倍數后溶液的pH:①>② | |
| B. | 若②與③混合后溶液呈中性,則在常溫下Ka(CH3COOH)=Kb(NH3.NH3) | |
| C. | ③與④中已電離的水分子的數目相等 | |
| D. | ②與④混合所得溶液顯酸性,則:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 反應在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 相同溫度下,起始時向容器中充入1.0 mol PCl5、0.20mol PCl3 和0.20 mol Cl2,反應達到平衡前v(正)>v(逆) | |
| C. | 保持其他條件不變,升高溫度,平衡時c(PCl3)=0.11mol•L-1,則反應的△H<0 | |
| D. | 相同溫度下,起始時向容器中充入2.0 mol PCl3 和2.0mol Cl2,達到平衡時,PCl3 的轉化率小于80% |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.01molMg在空氣中完全燃燒生成MgO和Mg3N2,轉移電子數目為0.02NA | |
| B. | 常溫常壓下,18.00克重水(D2O)中所含電子數約為10NA | |
| C. | 在熔融狀態下1molNaHSO4所含陽離子數為2NA | |
| D. | 1mol FeCl3完全水解轉化為氫氧化鐵膠體后能生成NA個膠粒 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃硫酸的作用,脫水劑、強氧化劑 | B. | “黑面包”的主要成分:C | ||
| C. | 氣體的主要成分:SO2、CO2 | D. | 白色沉淀只有CaCO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只要有化學鍵斷裂的變化一定是化學變化 | |
| B. | 并不是所有化學反應的速率都與壓強有關 | |
| C. | 可逆反應達到平衡后,正、逆反應速率相等但不為零 | |
| D. | 裝有NO2和N2O4混合氣的密閉燒瓶加熱后,顏色變深,說明該化學平衡發生了移動 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com