
| 時間/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 氫氣體積/mL | 0 | 50 | 120 | 232 | 290 | 310 |
分析 (1)先計算每個時間段的氣體體積,然后根據相同條件下,氣體體積與反應速率的關系判斷反應速率大小,根據該反應與能量變化的關系判斷速率變化原因;
(2)先求出氣體的物質的量,然后計算鹽酸變化的物質的量,利用速率公式計算即可;
(3)根據濃度、電解質的強弱對反應速率的影響判斷.
解答 解:0~1 min、1~2 min、2~3 min、3~4 min、4~5min,各時間段的氣體體積分別為:50 mL、70mL、112 mL、58 mL、20 mL,
(1)、相同通條件下,反應速率越大,相同時間內收集的氣體越多;過計算得,反應速率最大的時間段是2~3 min,;原因是:該反應是放熱反應,溫度越高,反應速率越大,故答案為:先增大后減小;開始時因反應放熱速率增大,隨反應進行鹽酸濃度降低,速率減小;
(2)2~3 min生成氫氣的體積是112 mL,設需要鹽酸的物質的量為xmol,
Zn+2HCl=ZnCl2 +H2 ↑
2 mol 22.4L
xmol 0.112L
則:x=0.01
所以v(HCl)=$\frac{\frac{△n}{V}}{△t}$=0.1mol/(L.min)
故答案為:0.1mol/(L.min);
(3)改變化學反應速率的方法有:改變溶液的濃度、改變溶液的溫度、改變固體的表面積等;
A.加蒸餾水,溶液的體積增大,濃度降低,反應速率減小,但生成的氣體的量不變,故A正確;
B.加NaNO3溶液中硝酸根離子與氫離子構成強氧化性體系,不生成氫氣而生成氮的氧化物,所以生成氫氣的量減少,故B錯誤;
C.加Na2CO3溶液,溶液的體積增大,鹽酸的濃度降低,但鹽酸和碳酸鈉反應生成二氧化碳,氫氣的量減小,故C錯誤;
D.CH3COONa溶液中的醋酸根離子與氫離子結合生成醋酸,溶液中的游離的氫離子的濃度減少,但提供氫離子的能力相同,所以生成氫氣的量不變,故D正確
E.加CuSO4溶液,能形成銅鋅原電池,加快反應速率,故E錯誤;
故選AD.
點評 本題主要考查化學反應速率的影響因素,題目難度中等,需要注意的是反應過程中濃度以及溫度的變化,明確化學反應速率的概念及計算方法,注重基礎知識的積累.


 靈星計算小達人系列答案
靈星計算小達人系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 第一電離能 | 電負性 | 晶格能 | 沸點 |
| O<N | Cl<F | NaCl<CaO | HF>HCl |
| 共價鍵 | H-Cl | O=O | H-O | Cl-Cl |
| 鍵能/kJ•mol-1 | 431 | 498 | 463 | 243 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 元素代號 | X | Y | Z | W |
| 原子半徑/pm | 160 | 143 | 102 | 74 |
| 主要化合價 | +2 | +3 | +6、+4、-2 | -2 |
| A. | Y的最高價氧化物對應的水化物能溶于稀氨水 | |
| B. | X和Y的金屬性X<Y | |
| C. | 氣態氰化物的穩定性H2Z<H2W | |
| D. | ZW3通常用單質Z與單質W反應制備 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
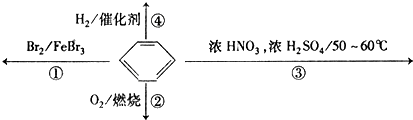
| A. | 反應①為取代反應,有機產物的密度比水小 | |
| B. | 反應②為氧化反應,反應現象是火焰明亮并帶有較多的黑煙 | |
| C. | 反應③為取代反應,有機產物是一種烴 | |
| D. | 反應④1mol苯最多與3molH2發生加成反應,是因為苯分子含有三個碳酸雙鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分離液態空氣制氮氣 | |
| B. | 閃電將空氣中的N2轉化成NO | |
| C. | 工業上合成氮 | |
| D. | 豆科植物將空氣中的N2轉化為化合態氮 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 轉化率(%) | 0.1MPa | 0.5MPa | 1.0MPa | 10MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 能與碳酸鈉反應產生氣體 | B. | 能被酸性高錳酸鉀氧化 | ||
| C. | 能發生酯化反應 | D. | 能發生水解反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某銨態氮肥由W、X、Y、Z 4種短周期元素組成,其中W的原子半徑最小.
某銨態氮肥由W、X、Y、Z 4種短周期元素組成,其中W的原子半徑最小. ;
; ;
;查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com