
| A. | Fe分別與氯氣和稀鹽酸反應所得氯化物相同 | |
| B. | K、Zn分別與不足量的稀硫酸反應所得溶液均呈中性 | |
| C. | Li、Na、K的原子半徑和密度隨原子序數的增加而增大 | |
| D. | C、S、Cl的最高價氧化物對應水化物的酸性逐漸增強 |
分析 A、根據氯氣具有強氧化性,和鐵反應產生氯化鐵,而稀鹽酸和鐵反應產生氯化亞鐵分析;
B、根據硫酸鉀為強酸強堿鹽,而硫酸鋅為強酸弱堿鹽分析;
C、根據電子層數越多,原子半徑越大分析;
D、根據非金屬性越強,最高價氧化物對應的水化物的酸性越強分析.
解答 解:A、氯氣具有強氧化性,和鐵反應產生氯化鐵,而稀鹽酸和鐵反應產生氯化亞鐵,故A錯誤;
B、硫酸鉀為強酸強堿鹽,而硫酸鋅為強酸弱堿鹽,因此鉀和鋅反應產生的氯硫酸鉀、硫酸鋅分別顯中性和酸性,故B錯誤;
C、電子層數越多,原子半徑越大,Li、Na、K的電子層數逐漸增大,因此半徑是增大的,但是密度逐漸減小,故C錯誤;
D、C、S、Cl的非金屬性增強,因此最高價氧化物對應的水化物的酸性也逐漸增強,故D正確;
故選D.
點評 本題考查了元素周期表的運用,明確規律并熟練其意義是解題的關鍵,另外熟練掌握氯氣的強氧化性.


 走進文言文系列答案
走進文言文系列答案科目:高中化學 來源: 題型:選擇題
| A. | 38.5mol/L | B. | 32.7mol/L | C. | 20.4mol/L | D. | 18.4mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
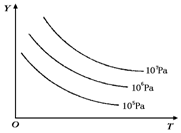 有下列可逆反應:L(s)+G(g)?2R(g)(正反應吸熱),外界溫度、壓強的變化對該反應的影響如圖所示:則下列對圖中縱坐標Y的含義的有關敘述中正確的是( )
有下列可逆反應:L(s)+G(g)?2R(g)(正反應吸熱),外界溫度、壓強的變化對該反應的影響如圖所示:則下列對圖中縱坐標Y的含義的有關敘述中正確的是( )| A. | G的轉化率 | B. | 平衡混合氣中R的體積分數 | ||
| C. | 平衡混合氣中G的體積分數 | D. | 平衡混合氣中L的體積分數 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | FeCl3溶液使藍色石蕊試紙變紅:Fe3++3H2O═3H++Fe(OH)3 | |
| B. | FeCl3溶液中滴加氨水出現紅褐色沉淀:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 用FeCl3溶液腐蝕印刷電路板:Fe3++Cu═Cu2++Fe2+ | |
| D. | 檢驗溶液中的Fe3+用KSCN溶液:Fe3++3SCN-?Fe(SCN)3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲烷的標準燃燒熱為890.3kJ.mol-1,則甲烷燃燒的熱化學方程式可表示為:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ.mol-1 | |
| B. | CO(g)的燃燒熱是283.0 kJ/mol,則CO2(g)═2CO(g)+O2(g)的反應熱△H=+2×283.0 kJ/mol | |
| C. | NaOH和HCl反應的中和熱△H=-57.3kJ/mol,則H2SO4和Ca(OH)2反應的中和熱△H=2×(-57.3)kJ/mol | |
| D. | 500℃、30MPa下,將0.5mol N2和1.5molH2置于密閉的容器中充分反應生成NH3(g),放熱19.3kJ,其熱化學方程式為:N2(g)+3H2(g)$?_{550℃,30Mpa}^{催化劑}$2NH3(g)△H=-38.6kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素 | T | X | Y | Z |
| 性質結構信息 | 原子核外s電子總數等于p電子總數;人體內含量最多的元素,且其單質是常見的助燃劑 | 單質為雙原子分子,分子中含有3對共用電子對,常溫下單質性質穩定,但其原子較活潑 | 第3周期元素的簡單離子中半徑最小 | 第4周期元素,M電子層為全充滿狀態,最外層只有一個電子的原子 |
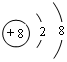 ;寫出元素X的氣態氫化物的電子式
;寫出元素X的氣態氫化物的電子式 ;X形成的單質分子,含1個σ鍵,2個π鍵.寫出Z元素原子的外圍電子排布式3d104s1;元素Y的原子核外共有2種形狀不同的電子云.
;X形成的單質分子,含1個σ鍵,2個π鍵.寫出Z元素原子的外圍電子排布式3d104s1;元素Y的原子核外共有2種形狀不同的電子云.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 為了加快過濾速度,可用玻璃棒攪拌過濾器中的液體 | |
| B. | 在蒸餾時應先打開冷凝水開關,待水充滿后再點燃酒精燈 | |
| C. | 分液時,分液漏斗中下層液體從下口放出,然后換一個燒杯將上層液體放出 | |
| D. | 在做蒸餾實驗時應將溫度計的水銀球浸沒在液體里 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com