
| 操作步驟 | 實驗現象 | 解釋原因 |
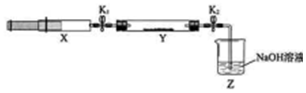
| 打開K1,推動注射器活塞,使X中的氣體緩慢通入Y管中 | ①Y管中紅棕色氣體慢慢變淺 | ②反應的化學方程式 8NH3+6NO2 $\frac{\underline{\;催化劑\;}}{\;}$7N2+12H2O |
| 將注射器活塞退回原處并固定,待裝置恢復到室溫 | Y管中有少量水珠 | 生成的氣態水凝集 |
| 打開K2 | ③Z中NaOH溶液產生倒吸現象 | ④反應后氣體分子數減少,Y管中壓強小于外壓 |
分析 打開K1,推動注射器活塞,使X中的氣體緩慢充入Y管中,則氨氣與二氧化氮發生歸中反應生成無色氮氣,所以看到現象為:紅棕色變淺;
依據8NH3+6NO2=7N2+12H2O以及氣態水凝聚判斷,反應后氣體分子數減少從而判斷打開K2發生的現象.
解答 解:打開K1,推動注射器活塞,使X中的氣體緩慢充入Y管中,則氨氣與二氧化氮發生歸中反應 生成無色氮氣,所以看到現象為:紅棕色氣體慢慢變淺;
根據反應8NH3+6NO2$\frac{\underline{\;催化劑\;}}{\;}$7N2+12H2O以及裝置恢復至室溫后氣態水凝聚可判斷,反應后氣體分子數減少,裝置內壓強降低,所以打開K2在大氣壓的作用下發生倒吸;
故答案為:
| 操作步驟 | 實驗現象 | 解釋原因 |
| 紅棕色氣體慢慢變淺 | 8NH3+6NO2$\frac{\underline{\;催化劑\;}}{\;}$7N2+12H2O | |
| Z中NaOH溶液產生倒吸現象 | 反應后氣體分子數減少,Y管中壓強小于外壓 |
點評 本題考查了氮氧化物的性質和反應現象的分析判斷,明確裝置的原理及制備氣體的一般程序是解題關鍵,題目難度不大.


科目:高中化學 來源: 題型:解答題
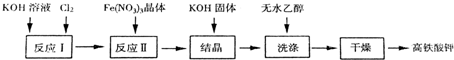
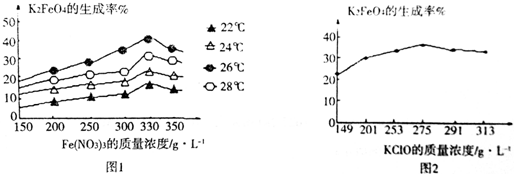
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
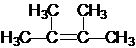 名稱為2,3-二甲基-2-丁烯
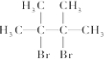
名稱為2,3-二甲基-2-丁烯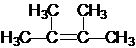 →
→
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/℃ | 25 | 90℃ | 100℃ |
| 水的離子積常數 | 1×10-14 | 3.8×10-13 | 1×10-12 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 微粒組 | 所加試劑 | 離子方程式 |
| A | NH4+、Mg2+、SO42- | 少量Ba(OH)2溶液 | NH4++SO42-+Ba2++OH-=BaSO4↓+NH3•H2O |
| B | Mg2+、HCO3-、Cl- | 過量NaOH溶液 | Mg2++2HCO3-+2OH-=MgCO3-↓+CO32-+2H2O |
| C | H+、Na+、NO3- | Fe粉 | Fe+2H+=Fe2++H2↑ |
| D | Ca2+、NH3•H2O、Cl- | 通入過量CO2 | NH3•H2O+CO2=NH4++HCO3- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
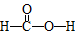 ,Ka=1.8×10-4),通常情況下是一種無色易揮發的液體.甲酸在濃硫酸作用下容易分解產生CO.某化學興趣小組的同學對HCOOH的性質進行了以下探究:
,Ka=1.8×10-4),通常情況下是一種無色易揮發的液體.甲酸在濃硫酸作用下容易分解產生CO.某化學興趣小組的同學對HCOOH的性質進行了以下探究: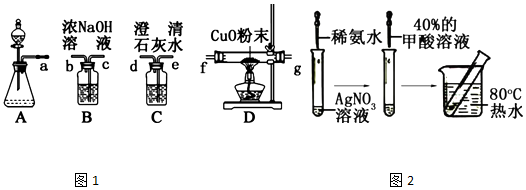
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③⑦ | B. | 除⑤⑥外 | C. | ②③⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
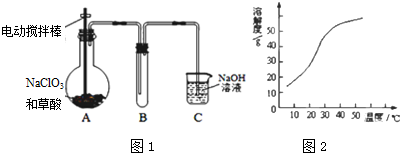
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com