
| 選項 | 微粒組 | 所加試劑 | 離子方程式 |
| A | NH4+、Mg2+、SO42- | 少量Ba(OH)2溶液 | NH4++SO42-+Ba2++OH-=BaSO4↓+NH3•H2O |
| B | Mg2+、HCO3-、Cl- | 過量NaOH溶液 | Mg2++2HCO3-+2OH-=MgCO3-↓+CO32-+2H2O |
| C | H+、Na+、NO3- | Fe粉 | Fe+2H+=Fe2++H2↑ |
| D | Ca2+、NH3•H2O、Cl- | 通入過量CO2 | NH3•H2O+CO2=NH4++HCO3- |
| A. | A | B. | B | C. | C | D. | D |
分析 根據離子之間不能結合生成沉淀、氣體、水等,不能發生氧化還原反應等,則離子大量共存,且加入試劑符合反應的先后順序,以此來解答.
解答 解:A.A.該組離子之間不反應,可大量共存,且加入少量Ba(OH)2溶液,發生Mg2++SO42-+Ba2++2OH-=BaSO4↓+Mg(OH)2↓,故A錯誤;
B.該組離子之間不反應,可大量共存,且加入過量NaOH溶液,發生Mg2++HCO3-+3OH-=H2O+Mg(OH)2↓+CO32-,故B錯誤;
C.該組離子之間不反應可以共存,加入鐵粉發生氧化還原反應,不生成氫氣,硝酸還原產物為一氧化氮,故C錯誤;
D.該組離子之間不反應可以共存,通入過量二氧化碳,反應離子方程式:NH3•H2O+CO2=NH4++HCO3-,故D正確;
故選:D.
點評 本題考查離子共存及離子反應,為高頻考點,把握常見離子之間的反應及與量有關的離子反應為解答的關鍵,側重分析與應用能力的綜合考查,題目難度不大.


 勵耘書業暑假銜接寧波出版社系列答案
勵耘書業暑假銜接寧波出版社系列答案科目:高中化學 來源: 題型:解答題

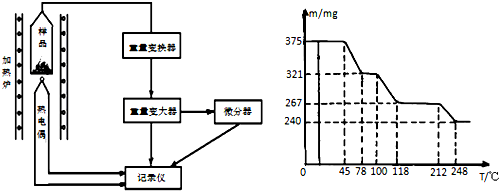
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、Mg2+、CO32-、I- | B. | H+、NO3-、Fe2+、Br- | ||
| C. | NH4+、K+、SO42-、Cl- | D. | Na+、S2-、Cu2+、SO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入少量Na2CO3固體,平衡①右移,平衡②左移,溶液中c(F-)增大 | |
| B. | 加入少量NaOH固體至c(F-)>c(HF),溶液一定呈堿性 | |
| C. | 加入少量Na至pH=8,則C(Na+)-c(F-)=0.99×10-7mol•L-1 | |
| D. | 加入少量鹽酸,$\frac{c({F}^{-})}{c(HF)•c(O{H}^{-})}$不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
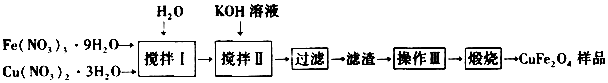
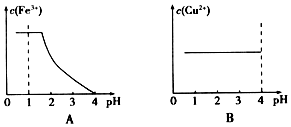
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
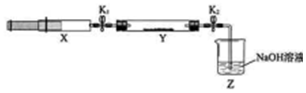
| 操作步驟 | 實驗現象 | 解釋原因 |
| 打開K1,推動注射器活塞,使X中的氣體緩慢通入Y管中 | ①Y管中紅棕色氣體慢慢變淺 | ②反應的化學方程式 8NH3+6NO2 $\frac{\underline{\;催化劑\;}}{\;}$7N2+12H2O |
| 將注射器活塞退回原處并固定,待裝置恢復到室溫 | Y管中有少量水珠 | 生成的氣態水凝集 |
| 打開K2 | ③Z中NaOH溶液產生倒吸現象 | ④反應后氣體分子數減少,Y管中壓強小于外壓 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可加入硫酸以提高電解質的導電性 | |
| B. | 放電時電池內部Li+向負極移動 | |
| C. | 放電時,Li發生還原反應 | |
| D. | 放電時電池正極反應為:FePO4+e-+Li+═LiFePO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2KMnO4+H2O2+3H2SO4═K2SO4+2MnSO4+3O2↑+4H2O | |
| B. | 2KMnO4+3H2O2+3H2SO4═K2SO4+2MnSO4+4O2↑+6H2O | |
| C. | 2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2↑+8H2O | |
| D. | 8KMnO4+2H2O2+12H2SO4═4K2SO4+8MnSO4+11O2↑+14H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
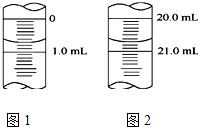 某學生用0.1000 mol•L-1KOH液滴定未知濃度的醋酸,其操作分解為如下幾步:
某學生用0.1000 mol•L-1KOH液滴定未知濃度的醋酸,其操作分解為如下幾步:| 實驗序號 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的體積(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com