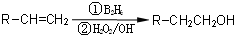分析:(1)根據實驗目的,②為制取二氧化碳裝置,實驗室中常用碳酸鈣與鹽酸反應,二氧化碳中混有氯化氫,需要用裝置④除去,然后用裝置③干燥,然后在①中進行鈉與二氧化碳的反應,然后用⑤檢驗反應產物,據此進行連接裝置;
(2)所選試劑的作用是增大溶液體積,可以用稀硝酸和硝酸鈉溶液,由于四氯化碳的密度大于鹽酸,也可以加入四氯化碳溶液,但是苯的密度小于鹽酸,加入苯不能使稀鹽酸與碳酸鈣接觸;
(3)二氧化碳與澄清石灰水反應生成碳酸鈣沉淀,當裝置⑤中澄清石灰水變渾濁說明裝置中空氣已經排凈;原因是空氣中的二氧化碳、水與鈉反應,需要排凈空氣,避免干擾實驗;
(4)Ⅰ.根據題干信息及反應現象判斷反應物、生成物,然后寫出反應的化學方程式;
Ⅱ.根據n=
計算出鈉的物質的量,再根據n=
計算出標況下224mL二氧化碳的物質的量,從而得出反應后生成碳酸鈉的物質的量;溶液中還有固體殘留,該固體只能為C,說明鈉與二氧化碳反應生成碳酸鈉和C,據此寫出反應的化學方程式.
解答:
解:(1)探究鈉與CO
2的反應,首先用鹽酸和碳酸鈣在②中反應制取二氧化碳氣體,制取的二氧化碳中混有揮發出來的HCl,需要用裝置④中的飽和碳酸氫鈉溶液除去HCl,然后用③濃硫酸干燥,再在①中進行鈉與二氧化碳的反應,最后用裝置⑤檢驗反應產物,所以裝置的連接順序為:g、d、e、a(b)、b(a)、h,
故答案為:g、d、e、a(b)、b(a)、h;
(2)A.NaNO
3溶液:加入硝酸鈉溶液后,增大了鹽酸的體積,可以使鹽酸與碳酸鈣接觸,故A正確;
B.CCl
4:四氯化碳的密度大于稀鹽酸,加入四氯化碳后會,四氯化碳層在混合液下層,從而使鹽酸與碳酸鈣接觸,故B正確;
C.苯:苯的密度小于鹽酸,加入苯后,苯在混合液上層,無法使稀鹽酸與碳酸鈣接觸,故C錯誤;
D.稀硝酸:加入稀硝酸后,可以增大溶液體積,使溶液與碳酸鈣接觸,故D正確;
故答案為:ABD;
(3)鈉化學性質比較活潑,能夠與空氣中的氧氣、水反應,所以點燃酒精燈之前應需要打開彈簧夾,讓CO
2充滿整個裝置,以便排盡裝置中的空氣,避免空氣中O
2、H
2O干擾實驗;當裝置裝置⑤中澄清石灰水變渾濁時,證明裝置中空氣已經排凈,
故答案為:裝置⑤中澄清石灰水變渾濁;排盡裝置中的空氣,以免空氣中O
2、H
2O干擾實驗;
(4)Ⅰ.裝置⑤PdCl
2溶液中觀察到有黑色沉淀,PdCl
2能被CO還原得到黑色的Pd,則黑色沉淀為Pd,鈉與二氧化碳反應生成了CO;裝置①中固體成分只有一種,且向固體中加入稀鹽酸產生能使澄清石灰水變渾濁的氣體,該氣體為二氧化碳,則鈉與二氧化碳反應生成碳酸鈉和CO,2Na+2CO
2Na
2CO
3+CO,
故答案為:2Na+2CO
2Na
2CO
3+CO;
Ⅱ.裝置①中鈉的質量為0.46g,鈉的物質的量為:n(Na)=
=0.02mol,
將裝置①中的固體加入到足量稀鹽酸中產生224mL(標準狀況)CO
2氣體,二氧化碳的物質的量為:n(CO
2)=
=0.01mol,則反應后生成碳酸鈉的物質的量為0.01mol,說明鈉完全轉化成了碳酸鈉;
溶液中還有固體殘留,根據化合價變化可知,殘留的固體只能為C,則鈉與二氧化碳反應生成了碳酸鈉和C,反應的化學方程式為:4Na+3CO
22Na
2CO
3+C,
故答案為:4Na+3CO
22Na
2CO
3+C.




 由碳元素構成的各種單質和化合物始終都是科學家研究的重要對象.
由碳元素構成的各種單質和化合物始終都是科學家研究的重要對象.

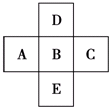 如圖所示,已知A元素的最低化合價為-3價,D元素和B元素可形成2種化合物.試回答下列問題(均用具體的元素符號回答):
如圖所示,已知A元素的最低化合價為-3價,D元素和B元素可形成2種化合物.試回答下列問題(均用具體的元素符號回答):