
 ,與B的離子具有相同電子數的微粒中,有一種分子可與鹽酸化合生成一種鹽,該反應的化學方程式是NH3+HCl═NH4Cl;
,與B的離子具有相同電子數的微粒中,有一種分子可與鹽酸化合生成一種鹽,該反應的化學方程式是NH3+HCl═NH4Cl; ,周期表中與C上下相鄰的同主族元素形成的氣態氫化物中,穩定性最強的是HF(填氫化物化學式).
,周期表中與C上下相鄰的同主族元素形成的氣態氫化物中,穩定性最強的是HF(填氫化物化學式).分析 A、B、C三種元素的原子具有相同的電子層數,而B的核電荷數比A大2,C原子的電子總數比B原子的電子總數多4,1molA的單質能跟鹽酸反應,在標準狀況下可置換出11.2L的H2,氫氣的物質的量是0.5mol,根據轉移電子相等知,A是第IA族元素,這時A轉變為與氖原子具有相同電子層結構的離子,則A是Na元素,B是Al元素,C是Cl元素,據此進行解答.
解答 解:A、B、C三種元素的原子具有相同的電子層數,而B的核電荷數比A大2,C原子的電子總數比B原子的電子總數多4,1molA的單質能跟鹽酸反應,在標準狀況下可置換出11.2L的H2,氫氣的物質的量是0.5mol,根據轉移電子相等知,A是第IA族元素,這時A轉變為與氖原子具有相同電子層結構的離子,則A是Na元素,B是Al元素,C是Cl元素.
(1)B為Al元素,鋁原子的核電荷數為13,含有3個電子層,最外層有3個電子,所以其原子結構示意圖為 ;與B的離子具有相同電子數的微粒中,有一種分子可與鹽酸化合生成一種鹽,則該分子是氨氣分子,氨氣和鹽酸反應生成氯化銨,所以該反應的化學方程式為NH3+HCl═NH4Cl,
;與B的離子具有相同電子數的微粒中,有一種分子可與鹽酸化合生成一種鹽,則該分子是氨氣分子,氨氣和鹽酸反應生成氯化銨,所以該反應的化學方程式為NH3+HCl═NH4Cl,
故答案為: ;NH3+HCl═NH4Cl;
;NH3+HCl═NH4Cl;
(2)A和C是形成的化合物是氯化鈉,屬于離子化合物,其電子式為 ;元素的非金屬性越強,其氣態氫化物越穩定,同一主族元素中,元素的非金屬性隨著原子序數的增大而減小,周期表中與C上下相鄰的同主族元素形成的氣態氫化物中,穩定性最強的是HF,
;元素的非金屬性越強,其氣態氫化物越穩定,同一主族元素中,元素的非金屬性隨著原子序數的增大而減小,周期表中與C上下相鄰的同主族元素形成的氣態氫化物中,穩定性最強的是HF,
故答案為: ;HF;
;HF;
(3)A的最高價氧化物的水化物是氫氧化鈉,B的最高價氧化物的水化物是氫氧化鋁,氫氧化鋁能和強堿反應生成鹽和水,所以其離子方程式為Al(OH)3+OH-=AlO2-+2H2O,
故答案為:Al(OH)3+OH-=AlO2-+2H2O.
點評 本題考查了位置結構和性質的相互關系,題目難度中等,正確推斷元素是解本題關鍵,氫氧化鋁和氫氧根離子反應方程式的書寫是常考查點,也是易錯點.


科目:高中化學 來源: 題型:解答題
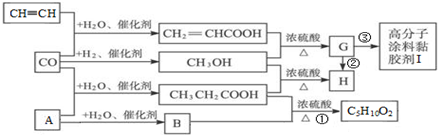
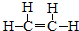 .
.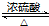 CH3CH2COOC2H5+H2O,指出②的反應類型加成反應.
CH3CH2COOC2H5+H2O,指出②的反應類型加成反應.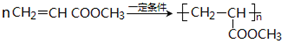 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
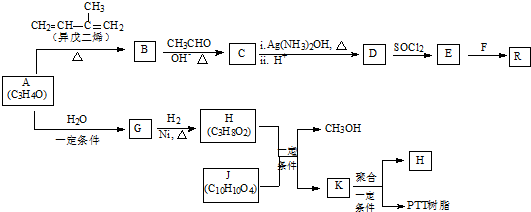
 天然氣的主要成分是甲烷,含有少量的羰基硫(COS)、乙硫醇(C2H5SH)等氣體.
天然氣的主要成分是甲烷,含有少量的羰基硫(COS)、乙硫醇(C2H5SH)等氣體. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
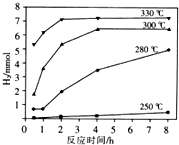
| A. | 平均反應速度:乙>甲 | B. | 平衡時SO3的物質的量甲>乙 | ||
| C. | 平衡時SO2的轉化率:乙>甲 | D. | 平衡時混合氣體的密度甲<乙 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學反應中的能量變化通常表現為熱量的變化 | |
| B. | 吸熱反應一定需要加熱的條件 | |
| C. | 化學鍵的斷裂和形成是化學反應中能量變化的主要原因 | |
| D. | 反應物和生成物總能量的相對大小決定化學反應放出還是吸收能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ═CHCOOCH2CH=CHCH2OOCH═
═CHCOOCH2CH=CHCH2OOCH═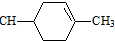
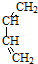 +
+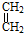 →
→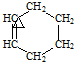
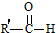 +
+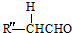 $→_{△}^{OH-}$R′CH
$→_{△}^{OH-}$R′CH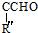 +H2O
+H2O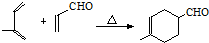 .
.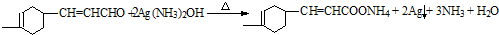 .
.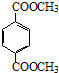 .
.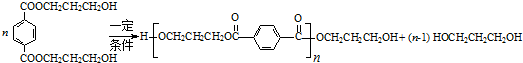 .
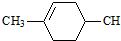
.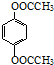 (鄰、間、對三種中的任一種).
(鄰、間、對三種中的任一種).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 電離能 | I1 | I2 | I3 | I4 | … |
| Im/kJ•mol-1 | 578 | 1 817 | 2 745 | 11 578 | … |
| A. | N | B. | Al | C. | Si | D. | Zn |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 冬天,塊狀的鋅與2mol/L稀硫酸溶液反應 | |
| B. | 冬天,粉末狀的鋅與2mol/L稀硫酸溶液反應 | |
| C. | 夏天,塊狀的鋅與2mol/L稀硫酸溶液反應 | |
| D. | 夏天,粉末狀的鋅與2mol/L稀硫酸溶液反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com