
 a、b、c、d是四種原子序數依次增大的短周期元素.a原子的電子層數為n,核內質子數是2n2-1,最外層電子數為2n+l;b、d同主族,能形成兩種中學常見的化合物;c與b組成的化合物是一種兩性氧化物,工業上通過電解該化合物可冶煉c單質;e原子有四個能層,其未成對電子數在同周期是最多的.回答下列問題:
a、b、c、d是四種原子序數依次增大的短周期元素.a原子的電子層數為n,核內質子數是2n2-1,最外層電子數為2n+l;b、d同主族,能形成兩種中學常見的化合物;c與b組成的化合物是一種兩性氧化物,工業上通過電解該化合物可冶煉c單質;e原子有四個能層,其未成對電子數在同周期是最多的.回答下列問題:分析 a、b、c、d是四種原子序數依次增大的短周期元素.a原子的電子層數為n,核內質子數是2n2-1,最外層電子數為2n+l,若n=3,則a為Cl,b、c、d不能都處于短周期,不符合題意,則n=2,a為N元素;b、d同主族,能形成兩種中學常見的化合物,則b為O元素、d為S元素;c與b組成的化合物是一種兩性氧化物,工業上通過電解該化合物可冶煉c單質,則c為Al;e原子有四個能層,其未成對電子數在同周期是最多的,外圍電子排布為3d54s1,則e為Cr.
解答 解:a、b、c、d是四種原子序數依次增大的短周期元素.a原子的電子層數為n,核內質子數是2n2-1,最外層電子數為2n+l,若n=3,則a為Cl,b、c、d不能都處于短周期,不符合題意,則n=2,a為N元素;b、d同主族,能形成兩種中學常見的化合物,則b為O元素、d為S元素;c與b組成的化合物是一種兩性氧化物,工業上通過電解該化合物可冶煉c單質,則c為Al;e原子有四個能層,其未成對電子數在同周期是最多的,外圍電子排布為3d54s1,則e為Cr.
(l)a為N元素,在周期表中的位置:第二周期VA族;原子有四個能層,其未成對電子數在同周期是最多的,價電子電子排布式為3d54s1,
故答案為:第二周期VA族;3d54s1;
(2)同周期隨原子序數增大,元素第一電離能呈增大趨勢,同主族自上而下元素第一電離能減小,故原子的第一電離能由大到小的順序是:O>S>Al,
故答案為:O>S>Al;
(3)a和b形成的離子W呈平面正三角形,中心原子雜化軌道數目為3,其中心原子的雜化類型為 sp2雜化,由于非金屬性O>N、O>S,故氫化物中H2O最穩定,
故答案為:sp2雜化;H2O;
(4)晶胞中Al原子數目為8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞中Fe原子數目為8,則該合金的化學式為AlFe2,
故答案為:AlFe2;
(5)a和b形成的離子W呈平面正三角形,則W為NO3-,b、d組成的極性分子為SO2,SO2通入含少量NO3-離子的BaCl2水溶液中,有NO氣體生成.發生反應的離子方程式為:3SO2+2NO3-+3Ba2-+2H2O=3BaSO4↓+2NO↑+4H+,
故答案為:3SO2+2NO3-+3Ba2-+2H2O=3BaSO4↓+2NO↑+4H+.
點評 本題是對物質結構與性質的考查,涉及核外電子排布、電離能、雜化方式與空間構型、晶胞計算、氧化還原反應等,熟練掌握元素化合物性質,掌握雜化方式與微粒空間構型關系.


 超能學典應用題題卡系列答案
超能學典應用題題卡系列答案科目:高中化學 來源: 題型:解答題
 環境問題已經是我國面臨的重大問題.
環境問題已經是我國面臨的重大問題.| 化學鍵 | C=O | H-H | C-C | C-H | O-H | C-O |
| 鍵能/kJ、mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 系統命名:2,6二甲基辛烷;
系統命名:2,6二甲基辛烷; ;
; ;
;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
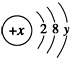 ( y≠0 ).請回答:
( y≠0 ).請回答:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 以惰性材料為電極,KOH溶液為電解質構成原電池,負極反應式為H2-2e-=2H+ | |
| B. | 銅、鋅在稀硫酸溶液中構成原電池,正極反應式為2H++2e-=H2↑ | |
| C. | 以銅為電極將2Fe3++Cu=2Fe2++Cu2+設計成原電池,正極反應式為Cu-2e-=Cu2+ | |
| D. | 以鋁、鐵為電極,在氫氧化鈉溶液中構成原電池,負極反應式為Al-3e-=Al3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 20 mL 12 mol/L的鹽酸 | B. | 10 mL 18 mol/L的硫酸 | ||
| C. | 80 mL 2 mol/L的硫酸 | D. | 40 mL 14 mol/L的硝酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ${\;}_{53}^{131}$I的化學性質與${\;}_{53}^{127}$I相同 | |
| B. | ${\;}_{53}^{131}$I的原子序數為53 | |
| C. | ${\;}_{53}^{131}$I的原子核外電子數為78 | |
| D. | ${\;}_{53}^{131}$I的原子核內中子數多于質子數 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;
;查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com