
 環境問題已經是我國面臨的重大問題.
環境問題已經是我國面臨的重大問題.| 化學鍵 | C=O | H-H | C-C | C-H | O-H | C-O |
| 鍵能/kJ、mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
分析 (1)化學反應的焓變等于反應物各個化學鍵鍵能之和個產物各個物質化學鍵鍵能之和的差;
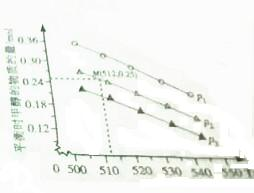
(2)由圖可知,M點對應的甲醇產量為0.25mol,據此列三段式結合平衡常數K的計算公式進行計根據,利用濃度熵和平衡常數之間的關系來判斷反應的方向;
(3)原電池負極發生氧化反應,甲醇在負極失去電子,堿性條件下生成碳酸根離子與水,根據電極反應式結合電子守恒進行計算.
解答 解:(1)化學反應的焓變等于反應物各個化學鍵鍵能之和個產物各個物質化學鍵鍵能之和的差,CO2(g)+3H2(g)?CH3OH(g)+H20(g)△H=2×803+436×3-(409×3+326+463×3)=-28(kJ/mol);故答案為:-28kJ/mol;
(2)由圖可知,M點對應的甲醇產量為0.25mol,則
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
開始 1 2.75 0 0
反應 0.25 0.75 0.25 0.25
平衡 0.75 2 0.25 0.25
又體積為1.0L,所以K=$\frac{0.25×0.25}{0.75×{2}^{3}}$=1.04×10-2,向該容器中投入1molCO2、0.5molH2、2molCH2OH、0.6molH2O,Qc=$\frac{0.6×2}{1×0.{5}^{3}}$=9.6>K,所以平衡向
逆方向移動,故答案為:逆;
(3)放電時,負極上甲醇失電子發生氧化反應,甲醇失電子和氫氧根離子反應生成碳酸根離子和水,電極反應式為CH3OH+8OH--6e-=CO32-+6H2O,燃料電池消耗標況下56L即2.5mol空氣時,此時消耗氧氣的物質的量是0.5mol,根據正極反應:O2+4e-+2H2O=4OH-,轉移電子是2mol,電解硫酸銅,陽極上電極反應式為:4OH--4e-=O2↑+2H2O,產生氧氣是0.5mol,陰極上依次發生:Cu2++2e-→Cu,2H++2e-→H2↑,500mL1mol/LCuSO4中含有銅離子是0.5mol,轉移電子是1mol,所以氫離子得到電子是1mol,產生氫氣0.5mol,理論上兩電極上電解產生氣體的總物質的量是1mol,故答案為:CH3OH+8OH--6e-=CO32-+6H2O;1mol.
點評 本題涉及化學平衡常數的計算和應用、反應熱的計算以及原電池的工作原理知識,注意知識的遷移應用是解題的關鍵,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 反應中消耗鋁的質量相同 | |
| B. | 反應中轉移的電子數相同 | |
| C. | 反應中消耗的HCl與NaOH物質的量相同 | |
| D. | 溶液增加的質量相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=12的溶液中:K+、Na+、AlO2-、CO32- | |
| B. | 在0.1mol•L-1的NaHCO3 溶液中:K+、Al3+、I-、Cl- | |
| C. | 與Al反應能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 使酚酞變紅色的溶液中:Na+、Al3+、SO42-、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 通過甲烷的電極(X)為電池的負極,通過氧氣的電極(Y)為電池正極 | |
| B. | 放電一段時間后,電解質溶液中KOH的物質的量不改變 | |
| C. | 在標準狀況下,通過5.6L氧氣,完全反應后有1.0mol的電子發生轉移 | |
| D. | 放電時,通過甲烷的一極附近的pH降低 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氨水中的溶質是NH3•H2O | |
| B. | NH3有堿性,所以能使濕潤的紅色石蕊試紙變藍色 | |
| C. | 所有的銨鹽都易溶于水,且受熱易分解 | |
| D. | 常溫下,濃硫酸、濃硝酸與鐵、鋁均不反應,所以可用鐵制的容器來儲存和運輸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
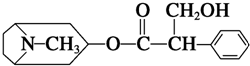 我國科學家發現金絲桃素對高致病性禽流感病毒殺滅效果良好,某種金絲桃素的結構簡式如圖所示:
我國科學家發現金絲桃素對高致病性禽流感病毒殺滅效果良好,某種金絲桃素的結構簡式如圖所示:| A. | ①和④ | B. | ②和④ | C. | ②和③ | D. | ①和③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 a、b、c、d是四種原子序數依次增大的短周期元素.a原子的電子層數為n,核內質子數是2n2-1,最外層電子數為2n+l;b、d同主族,能形成兩種中學常見的化合物;c與b組成的化合物是一種兩性氧化物,工業上通過電解該化合物可冶煉c單質;e原子有四個能層,其未成對電子數在同周期是最多的.回答下列問題:
a、b、c、d是四種原子序數依次增大的短周期元素.a原子的電子層數為n,核內質子數是2n2-1,最外層電子數為2n+l;b、d同主族,能形成兩種中學常見的化合物;c與b組成的化合物是一種兩性氧化物,工業上通過電解該化合物可冶煉c單質;e原子有四個能層,其未成對電子數在同周期是最多的.回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com