
分析 (1)依據燃燒熱的定義解答,表示燃燒熱的熱化學方程式中可燃物為1mol,產物為穩定氧化物;依據1g乙醇完全燃燒生成CO2和液態水時放熱23kJ,結合燃燒熱的定義計算求出1mol乙醇完全燃燒放出的熱量,然后寫出熱化學方程式;
(2)根據每生成23克NO2需要吸收16.95kJ熱量,計算2molNO2燃燒放出的熱量,結合化學方程式書寫熱化學方程式.注意物質的聚集狀態和反應熱的單位等問題.
解答 解:(1)燃燒熱是指:在25℃、101KPa時,1mol純凈物完全燃燒生成穩定的氧化物放出的熱量;
1g乙醇完全燃燒生成CO2和液態水時放熱23kJ,則1mol乙醇,質量為46g,完全燃燒生成穩定的氧化物放出的熱量為:46×23kJ=1058KJ,
其燃燒熱的熱化學方程式為:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1058 kJ•mol-1;
故答案為:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-10588 kJ•mol-1;
(2)適量的N2和O2完全反應,每生成23克NO2需要吸收16.95 kJ熱量,所以每生成92克NO2需要吸收67.8kJ熱量,則熱化學方程式為:N2(g)+2O2(g)=2NO2(g)△H=+67.8kJ/mol,
故答案為:N2(g)+2O2(g)═2NO2(g)△H=+67.8kJ/mol.
點評 本題考查了燃燒熱的概念以及燃燒熱的熱化學方程式的書寫,注意燃燒熱的熱化學方程式中可燃物的物質的量為1mol,產物必須是穩定的氧化物,題目較簡單,側重于考查學生的分析能力和計算能力.


 開心快樂假期作業暑假作業西安出版社系列答案
開心快樂假期作業暑假作業西安出版社系列答案 名題訓練系列答案
名題訓練系列答案科目:高中化學 來源: 題型:解答題
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某學生欲用已知物質的量濃度的鹽酸來測定未知物質的量濃度的NaOH溶液時,選擇甲基橙作指示劑.請填寫下列空白:
某學生欲用已知物質的量濃度的鹽酸來測定未知物質的量濃度的NaOH溶液時,選擇甲基橙作指示劑.請填寫下列空白:| 滴定次數 | 待測NaOH溶液的體積/mL | 0.100 0mol/L鹽酸的體積/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液體積/mL | ||
| 第一次 | 25.00 | 0.10 | 26.11 | 26.01 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.32 | 26.31 | 25.99 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
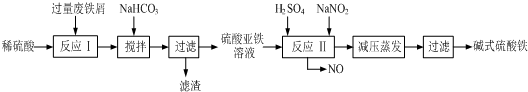
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 開始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 密閉容器中,9.6g 硫粉與 11.2g 鐵粉混合加熱生成硫化亞鐵 17.6g 時,放出 19.12KJ 熱量.則Fe(s)+S(s)═FeS(s)△H=-95.6KJ?mol-1 | |
| B. | 稀醋酸與 0.1mol?L-1NaOH 溶液反應:H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ?mol-1 | |
| C. | 已知,1molH2 完全燃燒生成液態水所放出的熱量為 285.5KJ,則水分解的熱化學方程式為:2H2O(l)═2H2(g)+O2(g)△H=-285.5KJ?mol-1 | |
| D. | 已知 2C(s)+O2(g)═2CO(g)△H=-221KJ?mol-1,則可知 C 的燃燒熱△H=-110.5KJ?mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.40mol | B. | 小于0.20mol | ||
| C. | 大于0.20mol | D. | 小于0.40mol,大于0.20mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 地殼中金屬元素的含量 | B. | 金屬的延展性 | ||
| C. | 金屬的導電性 | D. | 金屬活動性及冶煉的難易程度 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com