
分析 依據題干條件計算符合熱化學方程式對應量的焓變,根據熱化學方程式的書寫方法寫出,注意物質聚集狀態標注,焓變的正負.
解答 解:將2克液態苯(C6H6)物質的量=$\frac{2g}{78g/mol}$=$\frac{1}{39}$mol;完全燃燒生成液態水和CO2,放出83.6KJ的熱量,1mol苯燃燒放熱=83.6KJ×39mol=3260.4KJ;
反應的熱化學方程式為:C6H6(l)+$\frac{15}{2}$O2(g)→6CO2(g)+6H2O(l)△H=-3260.4KJ/mol,
故答案為:C6H6(l)+$\frac{15}{2}$O2(g)→6CO2(g)+6H2O(l)△H=-3260.4KJ/mol;
故答案為:C6H6(l)+$\frac{15}{2}$O2(g)→6CO2(g)+6H2O(l)△H=-3260.4KJ/mol.
點評 本題考查了焓變計算、熱化學方程式的書寫方法注意問題,題目難度不大,明確反應熱與物質的量之間的關系是解題的關鍵,側重于考查學生的分析能力和計算能力.


科目:高中化學 來源: 題型:解答題
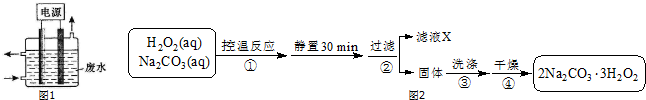
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氮是地球上含量較豐富的一種元素,氮及其化合物在工農業生產、日常生活中有著重要作用.
氮是地球上含量較豐富的一種元素,氮及其化合物在工農業生產、日常生活中有著重要作用.| t/℃ | 25 | 125 | 225 | … |
| K/(mol•L-1)-2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
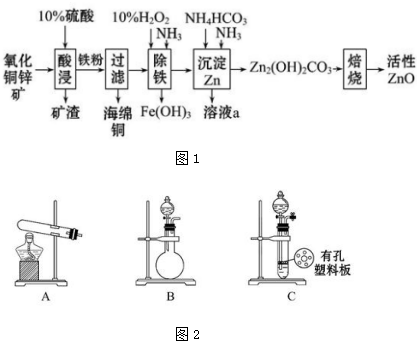
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蛋白質在體內代謝的最終產物是硝酸 | |
| B. | 灼燒蛋白質沒有明顯現象 | |
| C. | 誤食重金屬鹽會使人中毒,應立即喝牛奶、豆漿解毒 | |
| D. | 加熱會使蛋白質變性,因此生吃雞蛋比熟吃好 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 15mol 20% | B. | 20mol 20% | C. | 20mol 80% | D. | 40mol 80% |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com