
分析 (1)配制的是濃度約為0.1mol•L-1的NaOH溶液,500mL水的體積近似為溶液的體積;
(2)NaOH在空氣中極易吸水,導致NaOH的真實的質量偏小;
(3)在燒杯中稀釋后的醋酸溶液需要轉移到容量瓶中定容;
(4)堿滴定酸,酚酞作指示劑,開始為無色,滴定終點時變為紅色;
(5)滴定終點時,n(CH3COOH)=n(NaOH),以此計算.
解答 解:(1)由于配制的是濃度約為0.1mol•L-1的NaOH溶液,是比較粗略的配制,故該配制步驟是可行的,故答案為:可行;
(2)NaOH在空氣中極易吸水,導致NaOH的真實的質量偏小,則配制出的溶液的濃度偏小,故答案為:小;
(3)稀釋醋酸的操作為:用酸式滴定管量取一定體積的白醋,在燒杯中溶解,用玻璃棒引流注入100mL容量瓶,用膠頭滴管定容,故需要的儀器有酸式滴定管、燒杯、玻璃棒、膠頭滴管、100mL容量瓶,故答案為:100mL容量瓶;
(4)由于是用堿滴定酸,指示劑是酚酞,故當溶液變成淺紅色且30秒內不褪色時達到滴定終點,故答案為:溶液變成淺紅色且30秒內不褪色;
(5)稀釋后白醋中醋酸的物質的量濃度xmol/L,根據達滴定終點時,n(CH3COOH)=n(NaOH),可有xmol/L×0.02L=cmol•L-1×V×10-3L,解得x=$\frac{cV}{20}$mol/L,
故答案為:$\frac{cV}{20}$.
點評 本題考查物質含量測定,為高頻考點,把握滴定原理、實驗操作、儀器的使用為解答的關鍵,側重分析與實驗能力的考查,注意酸堿中和的實質,題目難度不大.


科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
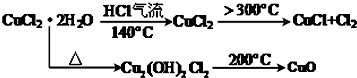
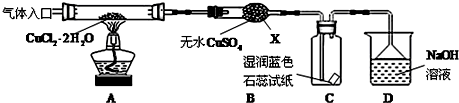
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某學生欲用已知物質的量濃度的鹽酸來測定未知物質的量濃度的NaOH溶液時,選擇甲基橙作指示劑.請填寫下列空白:
某學生欲用已知物質的量濃度的鹽酸來測定未知物質的量濃度的NaOH溶液時,選擇甲基橙作指示劑.請填寫下列空白:| 滴定次數 | 待測NaOH溶液的體積/mL | 0.100 0mol/L鹽酸的體積/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液體積/mL | ||
| 第一次 | 25.00 | 0.10 | 26.11 | 26.01 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.32 | 26.31 | 25.99 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
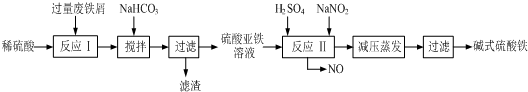
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 開始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
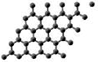
| A. | 石墨烯導電屬于化學變化 | B. | 石墨烯與金剛石結構相同 | ||
| C. | 纖維素與淀粉互為同分異構體 | D. | 纖維素屬于天然高分子化合物 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com