
分析 (1)鋁和銅與合適的電解質溶液構成原電池;
(2)鐵為負極,鐵離子的可溶性電解質溶液為電解質,負極發生氧化反應,正極發生還原反應書寫電極反應式;
(3)該原電池中Zn易失電子作負極、Cu作正極,負極上電極反應式為Zn-2e-=Zn2+、正極電極反應式為2H++2e-=H2↑,根據正負極反應式進行有關計算.
解答 解:(1)銅、鋁的金屬活潑性不同,遇到合適的電解質溶液易構成原電池,從而加快鋁的腐蝕,所以不能把銅導線和鋁導線連接在一起使用,
故答案為:形成原電池加速鋁導線的腐蝕;
(2)根據反應可知Fe應為負極,被氧化,正極可為C、Cu等,電解質溶液含有Fe3+,樂為氯化鐵或硫酸鐵等,裝置圖為 ,
,
電極反應式為:負極(鐵 )Fe-2e-═Fe2+,正極( 石墨)2Fe3++2e-═2Fe2+,故答案為: ;(鐵 )Fe-2e-═Fe2+,( 石墨)2Fe3++2e-═2Fe2+;
;(鐵 )Fe-2e-═Fe2+,( 石墨)2Fe3++2e-═2Fe2+;
(3)原電池中陰離子向負極移動,該原電池中Zn易失電子作負極、Cu作正極,負極上電極反應式為Zn-2e-=Zn2+、正極電極反應式為2H++2e-=H2↑,得失電子相同時,將正負極電極反應式相加得電池反應式為Zn+2H+=Zn2++H2↑,當有1mol電子通過時,負極上溶解m(Zn)=$\frac{1mol}{2}$×65g/mol=32.5g,正極上析出n(H2)=$\frac{1mol}{2}$=0.5 mol,故答案為:負;32.5;0.5.
點評 本題考查了原電池原理,知道正負極的判斷方法及正負極上發生的反應即可解答,注意:只有得失電子相同時正負極電極反應式相加才能得到電池反應式,否則得不到電池反應式.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 酸性:HClO4<HBrO4<HIO4 | B. | 堿性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 穩定性:HCl<H2S<PH3 | D. | 還原性:Cl->Br->I- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
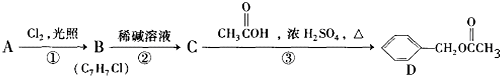
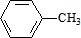 ,C的名稱:苯甲醇
,C的名稱:苯甲醇 +Cl2 $\stackrel{光照}{→}$
+Cl2 $\stackrel{光照}{→}$ 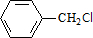 +HCl,取代反應
+HCl,取代反應 ,取代反應
,取代反應 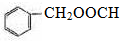 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol阿司匹林(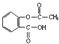 )與足量的NaOH溶液反應,消耗NaOH最大的物質的量為2mol )與足量的NaOH溶液反應,消耗NaOH最大的物質的量為2mol | |
| B. | 汽油、柴油等礦物油與植物油主要成分都是烴,均可以萃取溴水中的溴 | |
| C. | 丙氨酸和苯丙氨酸脫水,最多可生成4種二肽 | |
| D. | 苯酚能與溴水反應,苯不能與溴水反應,說明苯環對羥基有影響 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 所有自發進行的化學反應都是放熱反應 | |
| B. | 放熱反應一定比吸熱反應的反應速率快 | |
| C. | 由焓判據和熵判據組合而成的復合判據,將更適合于所有的反應過程 | |
| D. | 反應速率快的反應,其反應物的轉化率一定高 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
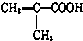 )$\stackrel{一定條件}{→}$PMAA
)$\stackrel{一定條件}{→}$PMAA .
. $→_{△}^{濃硫酸}$CH2=C(CH3)-COOH+H2O
$→_{△}^{濃硫酸}$CH2=C(CH3)-COOH+H2O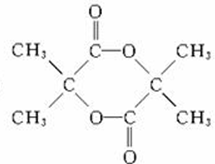 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在正極上發生還原反應 | B. | 化學性質較活潑的金屬為正極 | ||
| C. | 在外電路,電子流出正極 | D. | 是由電能轉化為化學能的裝置 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 測定時間/h | 0 | 1 | 2 | 3 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com