
| 溫度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
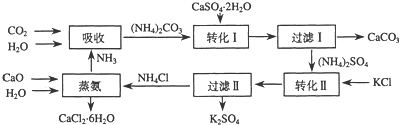
分析 由流程圖可知,吸收環節:2NH3+CO2+H2O生成碳酸銨;轉化Ⅰ環節:碳酸銨和石膏懸濁液反應生成CaCO3+(NH4)2SO4,經過濾后分離;轉化Ⅱ:(NH4)2SO4和KCl的飽和溶液反應得到NH4Cl和K2SO4經過濾Ⅱ分離;蒸氨環節的為CaO、H2O、NH4Cl生成為CaCl2.6H2O和NH3.
(1)根據箭頭的方向判斷不難得出最初的原料.加入的原料箭頭指向方框;箭線上面的物質為中間產物,箭頭指向的產物.
流程圖分析:
吸收環節:2NH3+CO2+H2O生成碳酸銨;
轉化Ⅰ環節:碳酸銨和石膏懸濁液反應生成CaCO3+(NH4)2SO4,經過濾后分離;
轉化Ⅱ:(NH4)2SO4和KCl的飽和溶液反應得到NH4Cl和K2SO4經過濾Ⅱ分離;
蒸氨環節的為CaO、H2O、NH4Cl生成為CaCl2.6H2O和NH3.
(2)根據流程圖可知,石膏懸濁液中加入碳酸銨溶液后過濾,得到碳酸鈣與硫酸銨;CaSO4微溶且為懸濁液、CaCO3不溶,所以二者在離子方程式中均不拆;然后配平即可;
(3)過濾Ⅰ操作所得固體中,除CaCO3外還主要含有過量微溶的CaSO4;
(4)根據碳酸根離子與酸反應能生成二氧化碳考慮;
(5)根據圖表不同溫度下的溶解度,結合飽和溶液質量之比等于析出晶體質量之比計算;
(6)氯化鈣結晶水合物(CaCl2•6H2O)是目前常用的無機儲熱材料,是因為氯化鈣結晶水合物熔點低易熔化,且無毒,與易溶于水,能導電無關;
(7)根據綠色化學的特點進行分析.碳酸鈣用于制水泥原料、硫酸鈣和氯化鉀轉化為硫酸鉀和氯化鈣、氨在工藝中循環使用等(原子利用率高,沒有有害物質排放到環境中.
解答 解:(1)由流程圖可知,吸收環節:2NH3+CO2+H2O生成碳酸銨;轉化Ⅰ環節:碳酸銨和石膏懸濁液反應生成CaCO3+(NH4)2SO4,經過濾后分離;轉化Ⅱ:(NH4)2SO4和KCl的飽和溶液反應得到NH4Cl和K2SO4經過濾Ⅱ分離;蒸氨環節的為CaO、H2O、NH4Cl生成為CaCl2.6H2O和NH3.
故答案為:CaCO3(或CaO)、NH3、H2O;
(2)根據流程圖可知,石膏懸濁液中加入碳酸銨溶液后過濾得到碳酸鈣與硫酸銨,CaSO4微溶且為懸濁液、CaCO3不溶,所以在離子方程式中均不拆;然后配平即可;故答案為:CaSO4+CO32-=CaCO3+SO42-;
(3)CaSO4微溶且為懸濁液,故過濾Ⅰ操作所得固體中,除CaCO3外還主要含有過量微溶的CaSO4,
故答案為:CaSO4;
(4)碳酸根離子與酸反應能生成二氧化碳,所以可以用稀鹽酸來驗證碳酸根離子.
故答案為:取少量溶液,滴加稀鹽酸,若有氣泡產生則還含有CO32-,反之則不含有CO32-;
(5)根據圖表不同溫度下的溶解度,結合飽和溶液質量之比等于析出晶體質量之比計算,(100+18.2):(18.2-7.4)=591:x
x=54g;
故答案為:54;
(6)氯化鈣結晶水合物(CaCl2•6H2O)是目前常用的無機儲熱材料,是因為氯化鈣結晶水合物熔點低易熔化,且無毒,與易溶于水,能導電無關,
故答案為:ad;
(7)由綠色化學的特點可知,碳酸鈣用于制水泥原料、硫酸鈣和氯化鉀轉化為硫酸鉀和氯化鈣、氨在工藝中循環使用等(原子利用率高,沒有有害物質排放到環境中);
故答案為:碳酸鈣用于制水泥原料、硫酸鈣和氯化鉀轉化為硫酸鉀和氯化鈣、氨在工藝中循環使用等(原子利用率高,沒有有害物質排放到環境中).
點評 本題為工藝流程題,涉及原料、產品的判斷、方程式的書寫、檢驗、綠色化學等.做推斷題時要充分利用所給的信息,結合自己已學過的知識,進行有依據性的推測,難度較大.


科目:高中化學 來源: 題型:選擇題
| A. | S2- | B. | S | C. | SO42- | D. | SO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | FeO放入稀HCl中 | |
| B. | CuCl2的混合溶液中加入過量的鐵粉 | |
| C. | Fe在氯氣中燃燒后的產物 | |
| D. | 過量Fe粉放入FeCl3溶液中 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 開始沉淀 | 2.3 | 7.5 | 3.4 | 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
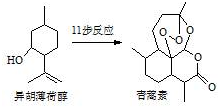 2015年我國藥物化學家屠吆吆因發明抗瘧疾新藥青蒿素和雙氫青蒿素被授予諾貝爾生理學或醫學獎.以異胡薄荷醇為起始原料是人工合成青蒿素的途徑之一(如圖).下列說法正確的是( )
2015年我國藥物化學家屠吆吆因發明抗瘧疾新藥青蒿素和雙氫青蒿素被授予諾貝爾生理學或醫學獎.以異胡薄荷醇為起始原料是人工合成青蒿素的途徑之一(如圖).下列說法正確的是( )| A. | 異胡薄荷醇遇FeCl3溶液顯紫色 | |
| B. | 異胡薄荷醇可發生消去反應、加成反應 | |
| C. | 青蒿素分子中含有5個手性碳原子 | |
| D. | 青蒿素在熱的酸、堿溶液中均可穩定存在 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 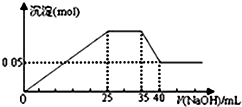 如圖表示向含Mg2+、Al3+、NH4+的鹽溶液中滴加NaOH溶液時,沉淀的量與NaOH的體積關系圖.則三種離子的物質的量之比為:n(Mg2+):n(Al3+):n( NH4+)=2:1:2,其中使用的NaOH的濃度為2 mol•L-1 | |
| B. |  如圖中曲線表示某反應過程的能量變化,當物質A(g)與B(g)反應生成物質C(g)是,△H>0,若使用正催化劑,E值會減小 | |
| C. | 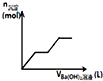 如圖可用來表示向鹽酸酸化的MgSO4溶液中加入Ba(OH)2溶液時,產生沉淀的物質的量(n)與加入Ba(OH)2溶液體積(V)之間的關系圖 | |
| D. | 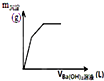 如圖表示向一定質量的明礬溶液中滴加Ba(OH)2溶液時,產生沉淀的質量(m)與加入Ba(OH)2溶液體積(V)之間的關系圖 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
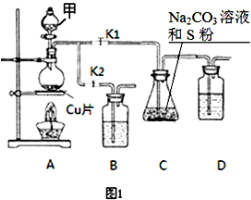 硫代硫酸鈉(Na2S2O3)在工業生產、醫藥制造業中被廣泛應用,工業普遍使用Na2SO3與硫磺(S)共煮得到,裝置如圖1.
硫代硫酸鈉(Na2S2O3)在工業生產、醫藥制造業中被廣泛應用,工業普遍使用Na2SO3與硫磺(S)共煮得到,裝置如圖1.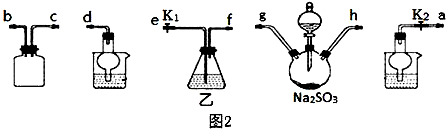
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Cl-、Na+ | |
| B. | 一定存在SO42-、CO32-、NH4+、Na+、Cl-,一定不存在K+、Na+ | |
| C. | c(CO32-)=0.01 mol•L-1,c(NH4+)>c(SO42-) | |
| D. | 如果上述6種離子都存在,則c(Cl-)>c(SO42-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
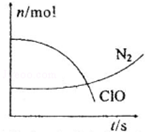
| A. | 還原劑是含CN-的物質,氧化產物不只有N2 | |
| B. | 氧化劑是ClO-,還原產物是HCO3- | |
| C. | 參與反應的氧化劑與還原劑的物質的量之比為5:2 | |
| D. | 標準狀況下若生成2.24LN2則轉移電子1mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com