
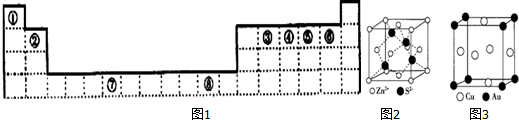
 ,
,分析 根據元素在周期表中的位置知,①②③④⑤⑥⑦⑧分別是H、Be、C、N、O、F、Cr、Cu元素.
(1)元素⑦的基態原子外圍電子為3d、4s電子,根據構造原理書寫其外圍電子排布式,根據最后填入電子名稱確定區域名稱,⑤是O元素,其2S、2P電子為其原子價電子;
(2)若元素①③⑤形成的某化合物顯酸性,經測定這三種元素的質量比為1:6:16,則這三種元素的原子個數之比=$\frac{1}{1}$:$\frac{6}{12}$:$\frac{16}{16}$=2:1:2,該化合物對氫氣的相對密度為23,則該化合物的相對分子質量為46,所以分子式為CH2O2,為HCOOH,根據價層電子對互斥理論確定原子雜化類型;
(3)同一周期元素中,元素的第一電離能隨著原子序數的增大而呈增大趨勢,但第VA族元素第一電離能大于相鄰元素;
由④和⑤兩種元素形成的與N3ˉ互為等電子體的分子是N2O,根據價層電子對互斥理論確定其VSEPR構型;
(4)根據晶胞的結構圖可求S2-的配位數;
(5)根據(SCN)2分子的結構N≡C-S-S-C≡N解答,根據均攤法計算出晶胞中Cu、Au原子數,根據$\frac{m}{V}$計算密度.
解答 解:根據元素在周期表中的位置知,①②③④⑤⑥⑦⑧分別是H、Be、C、N、O、F、Cr、Cu元素.
(1)元素⑦的基態原子外圍電子為3d、4s電子,根據構造原理書知其外圍電子排布式為3d54s1,該元素位于ds區,⑤是O元素,其2S、2P電子為其原子價電子,則⑤元素原子的價層電子的軌道表示式為 ,
,
故答案為:3d54s1;ds; ;
;
(2)若元素①③⑤形成的某化合物顯酸性,經測定這三種元素的質量比為1:6:16,則這三種元素的原子個數之比=$\frac{1}{1}$:$\frac{6}{12}$:$\frac{16}{16}$=2:1:2,該化合物對氫氣的相對密度為23,則該化合物的相對分子質量為46,所以分子式為CH2O2,為HCOOH,C原子和羰基上O原子都含有3個σ鍵,所以為sp2雜化,羥基上O原子含有2個σ鍵和2個孤電子對,所以為sp3雜化,
故答案為:sp2;sp3;
(3)同一周期元素中,元素的第一電離能隨著原子序數的增大而呈增大趨勢,但第VA族元素第一電離能大于相鄰元素,所以③④⑤⑥的第一電離能由大到小的順序為F>N>O>C,由④和⑤兩種元素形成的與N3ˉ互為等電子體的分子是N2O,該分子中價層電子對個數=2+$\frac{1}{2}$×(6-2×3)=2,所以為直線形分子,
故答案為:F>N>O>C;N2O;直線形;
(4)根據圖1,距離S2-最近的鋅離子有4個,即S2-的配位數為4,
故答案為:4;
(5)(SCN)2分子的結構N≡C-S-S-C≡N,1mol(SCN)2分子中含有共價鍵的數目為為9NA,Cu原子位于晶胞面心,數目為6×$\frac{1}{2}$=3,Au原子為晶胞頂點,數目為8×$\frac{1}{8}$=1,晶胞體積V=(a×10-7)3,密度$\frac{m}{V}$=$\frac{64×3+197}{\frac{{N}_{A}}{{a}^{3}×1{0}^{-21}}}$=$\frac{389}{{N}_{A}•{a}^{3}×1{0}^{-21}}$g•cm-3,
故答案為:9NA;$\frac{389}{{N}_{A}•{a}^{3}×1{0}^{-21}}$g•cm-3.
點評 本題考查了元素周期表和元素周期律的綜合應用,涉及原子雜化方式的判斷、微粒空間構型的判斷、晶體的密度求算等知識點,根據價層電子對互斥理論、原子結構等知識點來分析解答,注意第一電離能規律中的異常現象,為易錯點,掌握根據均攤法計算晶胞原子個數的高頻考題技巧,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 用試管取出試劑瓶中的 Na2CO3溶液,發現取量過多,為了不浪費,又把過量的試劑倒入試劑瓶中 | |
| B. | Ba(NO3)2 溶于水,可將含有 Ba(NO3)2 的廢液倒入水池中,再用水沖入下水道 | |
| C. | 用蒸發方法使 NaCl 從溶液中析出時,應將蒸發皿中 NaCl 溶液全部蒸干才停止加熱 | |
| D. | 用濃硫酸配制一定物質的量濃度的稀硫酸時,濃硫酸溶于水后,應冷卻至室溫才能轉移到容量瓶中 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用淀粉溶液檢驗溶液中是否存在碘離子 | |
| B. | 用氯化鋇溶液鑒別碳酸鈉溶液與硫酸鈉溶液 | |
| C. | 用Na2CO3溶液鑒別HCl溶液和H2SO4溶液 | |
| D. | 用焰色反應鑒別NaCl和KNO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鹽酸、硫酸、五水硫酸銅 | B. | NH3、Cu、空氣 | ||
| C. | NaOH、SO2、空氣 | D. | 氨水、食鹽、酒精 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | a c f h | B. | a c e g | C. | a c e f h | D. | b d e h |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO用于高爐煉鐵 | |
| B. | 用稀鹽酸除去熱水瓶膽壁上的水垢(主要成分是CaCO3) | |
| C. | 用鹽酸除鐵銹(鐵銹主要成分是Fe2O3) | |
| D. | 用小蘇打(NaHCO3)治療胃酸過多 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 50mL 0.50mol•L-1鹽酸與50mL 0.55mol•L-1 NaOH溶液進行中和反應,通過測定反應過程中所放出的熱量可計算中和熱,下列說法正確的是( )
50mL 0.50mol•L-1鹽酸與50mL 0.55mol•L-1 NaOH溶液進行中和反應,通過測定反應過程中所放出的熱量可計算中和熱,下列說法正確的是( )| A. | 從實驗裝置上看,除了缺少環形玻璃攪拌棒外沒有其他問題 | |
| B. | 大燒杯上如不蓋硬紙板,測得的中和熱數值會偏大 | |
| C. | 用相同濃度和體積的氨水代替NaOH溶液進行上述實驗,測得中和熱的數值會偏大 | |
| D. | 實驗中改用60 mL 0.50 mol•L-1鹽酸跟50 mL 0.55 mol•L-1 NaOH溶液進行反應,與上述實驗相比,所放出的熱量不相等,但是所求中和熱相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com