
| 實驗 編號 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 反應溫度/℃ | 反應時間/s |
| ① | 5.0mL | 5.0mL | 0 | 20 | 125 |
| ② | V1 | V2 | 2.0mL | 20 | 320 |
| ③ | 5.0mL | 5.0mL | 0 | 50 | 30 |
分析 (1)KMnO4和H2C2O4發生氧化還原反應生成錳離子、二氧化碳、水,根據得失電子守恒、電荷守恒配平離子方程式;
(2)溶液混合后顯示紫紅色,當紫紅色褪去后計時結束;
(3)實驗①和②研究濃度對反應速率的影響,要保證變量單一;
(4)根據規范的操作要求,實驗探究的基本原理分析回答;
(5)考慮催化劑對化學反應速率的影響.
解答 解:(1)KMnO4和H2C2O4發生氧化還原反應生成錳離子、二氧化碳、水,KMnO4和中錳降低了5價,1個H2C2O4分子中有2個+3價的C,所以升高1×2=2價,根據化合價升降總數相等可以確定KMnO4和H2C2O4的比例關系為:2:5,再根據電荷守恒配平離子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案為:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)實驗計時方法是從溶液混合開始記時,到紫紅色剛好褪去計時結束,
故答案為:紫紅色剛好褪去;
(3)實驗①和②研究濃度對反應速率的影響,高錳酸鉀作為指示劑,濃度不變,都是5.0mL,所以V1=5.0,溶液總體積為10.0mL,則V2=10.0-5.0-2.0=3.0,
故答案為:V1=5.0,V2=3.0;
(4)A.實驗時可以用量筒量取體積,故A錯誤;
B.實驗時應將5.0mLKMnO4溶液與5.0mL H2C2O4溶液混合后,再將盛有混合液的燒杯置于相應溫度的水浴中,立即按下秒表,至反應結束時,按下秒表,記錄讀數,故B錯誤;
C.在同一溫度下,最好采用平行多次實驗,以確保實驗數據的可靠性,故C正確;
D.實驗①和③對應物質的體積相同,可研究溫度對反應速率的影響,故D正確;
故答案為:CD;
(5)從實驗數據分析,MnSO4溶液在反應中為催化劑,可能原因為反應生成的Mn2+對反應有催化作用,
故答案為:反應生成的Mn2+對反應有催化作用.
點評 本題考查影響化學反應速率的因素,明確探究影響化學反應速率因素的方法,要認真分析題中信息,得出合理結論,本題難度中等.


 暑假銜接培優教材浙江工商大學出版社系列答案
暑假銜接培優教材浙江工商大學出版社系列答案 欣語文化快樂暑假沈陽出版社系列答案
欣語文化快樂暑假沈陽出版社系列答案科目:高中化學 來源: 題型:填空題
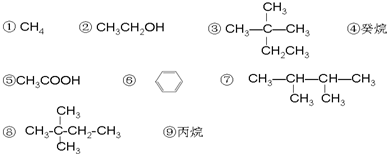
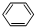 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$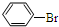 +HBr;
+HBr;查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 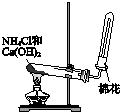 制備并收集氨氣 | B. |  制備氯氣 | ||
| C. | 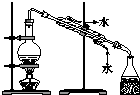 蒸餾海水得到淡水 | D. | 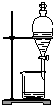 分離Na2CO3溶液與CH3COOC2H5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 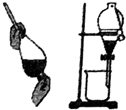 可用于分離苯和水的混合物 | |
| B. | 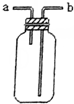 可用于收集H2、NH3、CO2、Cl2、HCl等氣體 | |
| C. | 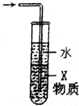 X若為四氯化碳,可用于吸收氨氣或氯化氫,并防止倒吸 | |
| D. | 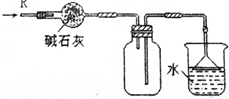 可用于干燥、收集氯化氫,并吸收多余的氯化氫 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 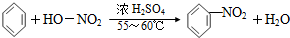 | |
| B. |  | |
| C. | 2 CH3CH2OH+O2 $→_{△}^{催化劑}$ 2 CH3CHO+2 H2O | |
| D. | CH2=CH2+HCl→CH3CH2Cl |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 碳 | 氮 | Y | |
| X | 硫 | Z |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
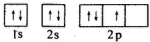
| A. | 洪特規則 | B. | 泡利原理 | C. | 能量最低原理 | D. | 洪特規則特例 |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年陜西省高二上月考一化學卷(解析版)) 題型:選擇題
若pH=3的酸溶液和pH=11的堿溶液等體積混合后溶液呈酸性,其原因可能是
A.生成了一種強酸弱堿鹽
B.弱酸溶液和強堿溶液反應
C.強酸溶液和弱堿溶液反應
D.一元強酸溶液和一元強堿溶液反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com