
| 滴定 次數 | 待測NaOH溶液的體積/mL | 0.1000mol/L鹽酸的體積/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.20 | 20.22 |
| 第二次 | 25.00 | 0.56 | 24.54 |
| 第三次 | 25.00 | 0.42 | 20.40 |
| A. | 0.0853mol/L | B. | 0.1000mol/L | C. | 0.0800mol/L | D. | 0.1250mol/L |
分析 先根據滴定前、滴定后數據計算出每次滴定中消耗鹽酸體積,然后判斷滴定數據是否有效,將有效的數據取平均值,從而得出消耗標準液體積,然后根據中和反應實質計算出消耗氫氧化鈉的物質的量,最后根據c=$\frac{n}{V}$計算出氫氧化鈉溶液的濃度.
解答 解:第一次滴定消耗鹽酸的體積為:20.22mL-0.20mL=20.02mL,第二次滴定消耗鹽酸的體積為:24.54mL-0.56mL=23.98mL,第三次滴定消耗鹽酸的體積為:20.40mL-0.42mL=19.98mL,
由于第二次滴定消耗鹽酸體積與其它兩次數據差別較大,應該舍棄,則其它兩次滴定消耗鹽酸的平均體積為:$\frac{20.02mL+19.98mL}{2}$=20.00mL,
根據中和反應原理可知:n(NaOH)=n(HCl),
所以測定該氫氧化鈉溶液的物質的量濃度為:c(NaOH)=$\frac{n(HCl)}{0.025L}$=$\frac{0.1000×0.02L}{0.025L}$=0.0800mol/L,
故選C.
點評 本題考查了中和滴定的計算,題目難度不大,正確處理滴定數據為解答關鍵,注意掌握中和滴定操作方法及中和反應實質,試題培養了學生的分析能力及化學計算能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | NaHCO3溶液中滴入偏鋁酸鈉溶液:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- | |
| B. | 飽和碳酸鈉溶液中通入過量二氧化碳氣體:CO32-+CO2+H2O═2HCO3- | |
| C. | NaHSO3溶液與FeCl3溶液混合溶液顏色變淺:SO32-+2Fe3++H2O═SO42-+2Fe2++2H+ | |
| D. | 向NH4Al(SO4)2溶液中加入Ba(OH)2溶液至SO42-恰好沉淀完全Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | Zn+H2SO4═ZnSO4+H2↑ | B. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | ||
| C. | S+O2$\frac{\underline{\;點燃\;}}{\;}$SO2 | D. | H2+Cl2$\frac{\underline{\;點燃\;}}{\;}$2HCl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 配制銀氨溶液時的總反應:Ag++3NH3•H20═[Ag(NH3)2]OH+NH4++2H20 | |
| B. | 向1 mL 0.l mol/L硝酸亞鐵溶液加入1 mL 0.1 mol/L的HI溶液:3 Fe2++N03-+4H+═3 Fe3++NO+2H2O | |
| C. | 向10 mL 0.lmol/L NH4Al(SO4)2溶液中加入0.1 mol/L Ba(OH)2溶液至恰好只有一種沉淀時:NH4++Al3++5OH-+2 SO42-+2Ba2+═AlO2-+NH3•H2O+2H2O+2BaSO4L | |
| D. | 向高錳酸鉀酸性溶液中滴加H202溶液,高錳酸鉀溶液紫紅色褪去:2MnO4-+7H2O2+6H+═2Mn2++6O2+lOH2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
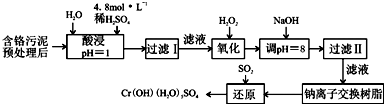
| 陽離子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 開始沉淀時的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全時的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 需要配置480mL該溶液,應選用500mL容量瓶 | |
| B. | 固體NaOH須放到燒杯中稱量 | |
| C. | 把稱好的固體加水溶解后馬上轉移到容量瓶中 | |
| D. | 定容時俯視刻度線,所配NaOH溶液濃度會偏大 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
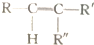 $\stackrel{高錳酸鉀酸性溶液}{→}$R-COOH+
$\stackrel{高錳酸鉀酸性溶液}{→}$R-COOH+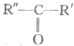
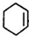 ,HOOC(CH2)4COOH.
,HOOC(CH2)4COOH.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 實驗室用銅制取硫酸銅,將適量硝酸分多次加入到銅粉與稀硫酸的混合物中加熱,使之反應完全,通過蒸發、結晶得到硫酸銅晶體.
實驗室用銅制取硫酸銅,將適量硝酸分多次加入到銅粉與稀硫酸的混合物中加熱,使之反應完全,通過蒸發、結晶得到硫酸銅晶體.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com