
| 陽離子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 開始沉淀時的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全時的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
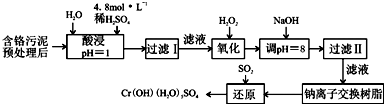
分析 含鉻污泥酸浸后濾去不溶物,濾液中加入過氧化氫,由(2)可知過氧化氫將Cr3+氧化為Cr2O72-,此外將Fe2+氧化為Fe3+,再加入NaOH調節pH=4,使Fe3+轉化為Fe(OH)3,過濾除去,濾液經過鈉離子交換樹脂后,被二氧化硫還原得到CrOH(H2O)5SO4,則鈉離子交換膜除去溶液中Al3+、Ca2+、Mg2+.
(1)酸浸時,為了提高浸取率可采取的措施是延長浸取時間、加快溶解速度等措施;硫酸浸取液中的金屬離子主要是Cr3+,其次是Fe3+、Al3+、Cu2+和Mg2+,酸浸是溶解物質為了提高浸取率,可以升高溫度增大物質溶解度,增大接觸面積增大反應速率,或加快攪拌速度等;
(2)過氧化氫是氧化劑可以氧化亞鐵離子為鐵離子;
(3)硫酸浸取液中的金屬離子主要是Cr3+,其次是Fe3+、Al3+、Cu2+和Mg2+,加入NaOH溶液使溶液呈堿性,Fe3+、Al3+、Cu2+轉化為沉淀除去;
(4)鈉離子交換樹脂交換的離子是陽離子,為溶液中鈣離子和鎂離子;
(5)依據流程圖中的轉化關系和產物,結合二氧化硫的還原性,利用氧化還原反應原理分析書寫,根據方程式計算或或電子守恒計算;
(6)①Fe為陽極,發生反應:Fe-2e-=Fe2+,得到還原性的Fe2+離子將還原Cr2O72-還原為Cr3+,陰極發生反應:2H++2e-=H2↑,溶液中氫離子濃度減小,溶液pH增大,Cr3+、Fe3+轉化為Cr(OH)3和Fe(OH)3沉淀除去;
②根據Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)、Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)計算.
解答 解:含鉻污泥酸浸后濾去不溶物,濾液中加入過氧化氫,由(2)可知過氧化氫將Cr3+氧化為Cr2O72-,此外將Fe2+氧化為Fe3+,再加入NaOH調節pH=4,使Fe3+轉化為Fe(OH)3,過濾除去,濾液經過鈉離子交換樹脂后,被二氧化硫還原得到CrOH(H2O)5SO4,則鈉離子交換膜除去溶液中Al3+、Ca2+、Mg2+.
(1)酸浸是溶解物質為了提高浸取率,可以將污泥粉碎、進行攪拌,以增大接觸面積,可以延長浸取時間,可以升高溫度,也可以過濾后再向濾渣中加入硫酸,進行多次浸取,合并浸取液,
故答案為:ABC;
(2)氧化過程中加入H2O2,除了能把Cr3+氧化為Cr2O72-外,另一個作用是氧化亞鐵離子為鐵離子,便于除去,反應的離子方程式為:2Fe2++2H++H2O2=2Fe3++2H2O,
故答案為:2Fe2++2H++H2O2=2Fe3++2H2O;
(3)硫酸浸取液中的金屬離子主要是Cr3+,其次是Fe3+、Al3+、Cu2+和Mg2+,加入NaOH溶液使溶液呈堿性,溶液PH=8,Fe3+、Cu2+、Al3+轉化為沉淀除去,過濾Ⅱ得到的沉淀為Fe(OH)3、Al(OH)3、Cu(OH)2,
故答案為:Fe(OH)3、Al(OH)3、Cu(OH)2;
(4)鈉離子交換樹脂的原理為:Mn++nNaR→MRn+nNa+,被交換的雜質離子是鈣離子和鎂離子,
故答案為:Ca2+,Mg2+;
(5)二氧化硫具有還原性,被濾液Ⅱ中通過離子交換后的溶液中Na2CrO4氧化為硫酸,Na2CrO4氧被還原為CrOH(H2O)5SO4,水溶液中生成氫氧化鈉溶液和硫酸反應生成硫酸鈉,依據原子守恒分析書寫配平;3SO2+2Na2CrO4+8H2O=2CrOH(H2O)3SO4↓+Na2SO4+2NaOH,每生成1molCr(OH)(H2O)3SO4,消耗SO2的物質的量1.5mol,或電子守恒計算,反應中Cr元素化合價由+6價降低為+3價,S元素由+4價升高為+6價,根據電子轉移守恒,消耗SO2物的質量為$\frac{1mol(6-3)}{6-4}$=1.5mol,
故答案為:1.5mol;
(6)①Fe為陽極,發生反應:Fe-2e-=Fe2+,得到還原性的Fe2+離子將還原Cr2O72-還原為Cr3+,陰極發生反應:2H++2e-=H2↑,溶液中氫離子濃度減小,溶液pH增大,Cr3+、Fe3+轉化為Cr(OH)3和Fe(OH)3沉淀除去,鐵電極與直流電源正極相連,加入適量NaCl的目的是增大溶液導電能力,
故答案為:正極;增大溶液導電能力;
②Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=2.0×10-13×c3(OH-)=4.0×10-38,
而Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.0×10-31,
聯立可得c(Cr3+)=3.0×10-6mol/L,
故答案為:3.0×10-6mol/L.
點評 本題以化學工藝流程為載體,考查物質分離提純、對原理與操作的分析評價、信息獲取與遷移運用、氧化還原反應計算、電解原理、溶度積有關計算等,題目綜合性強,側重考查學生分析解決問題的能力,是高考題的常見形式,關鍵是理解工藝流程,難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | A元素與C元素形成的分子不可能是非極性分子 | |
| B. | A、C、D元素分別與氫元素形成的最簡單氫化物中,D的氫化物沸點最高 | |
| C. | A、B、C、D四種元素的基態原子中,B的原子半徑最大 | |
| D. | A、B、C、D 四種元素對應單質的晶體都是分子晶體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HCl | B. | Na2O2 | C. | CuO | D. | FeCl3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 滴定 次數 | 待測NaOH溶液的體積/mL | 0.1000mol/L鹽酸的體積/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.20 | 20.22 |
| 第二次 | 25.00 | 0.56 | 24.54 |
| 第三次 | 25.00 | 0.42 | 20.40 |
| A. | 0.0853mol/L | B. | 0.1000mol/L | C. | 0.0800mol/L | D. | 0.1250mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | PH=1的稀硫酸中含有的H+數為0.1NA | |
| B. | 1mol苯分子中含有的碳碳雙鍵數為3NA | |
| C. | 18gH2O中含有的質子數為10NA | |
| D. | 50mL12mol•L-1的鹽酸與足量的MnO2共熱,生成的Cl2分子數為0.15NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
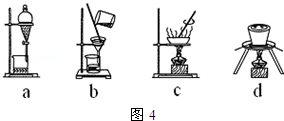
| 滴定次數 | 1 | 2 | 3 | 4 |
| KMnO4溶液體積/mL | 19.10 | 20.02 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | A | B | C | D |
| 操作 | 從CCl4萃取溴水中溴后的混合液中分離 | 二氧化錳與濃鹽酸反應制干燥氯氣 | 可用于制備并觀察氫氧化鐵沉淀 | 檢查裝置氣密性 |
| 實驗裝置 | 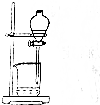 | 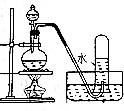 | 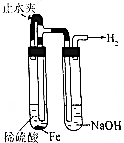 | 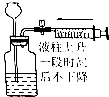 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com