
【題目】銅單質及其化合物在很多領域有重要的用途.
![]() 一
一![]() 如金屬銅用來制造電線電纜,超細銅粉可應用于導電材料、催化劑等領域中;CuCl和
如金屬銅用來制造電線電纜,超細銅粉可應用于導電材料、催化劑等領域中;CuCl和![]() 都是重要的化工原料,常用作催化劑、顏料、防腐劑和消毒劑等.
都是重要的化工原料,常用作催化劑、顏料、防腐劑和消毒劑等.
(1)超細銅粉的某制備方法如下:
![]()
![]() 中所含的化學鍵有 ______ .
中所含的化學鍵有 ______ .
(2)氯化亞銅![]() 的制備過程是:向
的制備過程是:向![]() 溶液中通入一定量
溶液中通入一定量![]() ,微熱,反應一段時間后即生成CuCl白色沉淀.反應的離子方程式為 ______ .
,微熱,反應一段時間后即生成CuCl白色沉淀.反應的離子方程式為 ______ .
![]() 二
二![]() 波爾多液是一種保護性殺菌劑,廣泛應用于樹木、果樹和花卉上,鮮藍色的膽礬晶體是配制波爾多液的主要原料.已知
波爾多液是一種保護性殺菌劑,廣泛應用于樹木、果樹和花卉上,鮮藍色的膽礬晶體是配制波爾多液的主要原料.已知![]() 的部分結構可表示如下:
的部分結構可表示如下:

(1)寫出銅原子價電子層的電子排布式 ______ ,與銅同周期的所有元素的基態原子中最外層電子數與銅原子相同的元素有 ______ ![]() 填元素符號
填元素符號![]() .
.
(2)請在上圖中把![]() 結構中的化學鍵用短線“--”表示出來.______
結構中的化學鍵用短線“--”表示出來.______
(3)往濃![]() 溶液中加入過量較濃的
溶液中加入過量較濃的![]() 直到原先生成的沉淀恰好溶解為止,得到深藍色溶液.小心加入約和溶液等體積的
直到原先生成的沉淀恰好溶解為止,得到深藍色溶液.小心加入約和溶液等體積的![]() 并使之分成兩層,靜置.經過一段時間后可觀察到在兩層“交界處”下部析出深藍色
并使之分成兩層,靜置.經過一段時間后可觀察到在兩層“交界處”下部析出深藍色![]() 晶體.實驗中所加
晶體.實驗中所加![]() 的作用是 ______ .
的作用是 ______ .
(4)![]() 晶體中呈正四面體的原子團是 ______ ,雜化軌道類型是
晶體中呈正四面體的原子團是 ______ ,雜化軌道類型是![]() 雜化的原子是 ______ .
雜化的原子是 ______ .
【答案】離子鍵、共價鍵和配位鍵 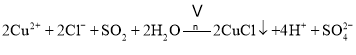
![]() K、Cr
K、Cr ![]() 加
加![]() ,減小“溶劑”
,減小“溶劑”![]() 和
和![]() 的極性,降低離子化合物
的極性,降低離子化合物![]() 的溶解度
的溶解度 ![]() N、S、O
N、S、O
【解析】
(一)根據物質的組成分析化學鍵的類型;根據氧化還原反應原理書寫離子方程式;(二)根據核外電子排布規律分析價層電子排布式;根據物質的極性于溶解性的關系分析解答;根據等電子體理論及價層電子對數分析微粒的空間結構及軌道雜化類型。
(一)(1)![]() 中硫酸根離子和
中硫酸根離子和![]() 存在離子鍵,N原子和銅原子之間存在配位鍵,
存在離子鍵,N原子和銅原子之間存在配位鍵,![]() 中H和N之間存在共價鍵,所以
中H和N之間存在共價鍵,所以![]() 中所含的化學鍵有共價鍵、離子鍵、配位鍵; 故答案為:共價鍵、離子鍵、配位鍵;
中所含的化學鍵有共價鍵、離子鍵、配位鍵; 故答案為:共價鍵、離子鍵、配位鍵;
(2)該反應中二氧化硫作還原劑生成硫酸根離子,銅離子得電子生成亞銅離子,反應條件是加熱,所以該反應的離子方程式為:![]() ;故答案為:
;故答案為:![]() ;
;
(二)(1)![]() 原子3d、4s能級上電子為其價電子,3d能級上有10個電子、4s能級上有1個電子,其價電子排布式為
原子3d、4s能級上電子為其價電子,3d能級上有10個電子、4s能級上有1個電子,其價電子排布式為![]() ;與銅同周期的所有元素的基態原子中最外層電子數與銅原子相同的元素K、Cr元素, 故答案為:
;與銅同周期的所有元素的基態原子中最外層電子數與銅原子相同的元素K、Cr元素, 故答案為:![]() ;K、Cr;
;K、Cr;
(2)該物質中含有配位鍵,Cu原子和水分子中O原子之間存在配位鍵,Cu原子提供空軌道、水分子中O原子提供孤電子對,硫酸根離子中S原子和O原子之間存在共價鍵,水分子中O原子和H原子之間存在共價鍵,所以存在的化學鍵有![]() , 故答案為:
, 故答案為:![]() ;
;
(3)加![]() ,減小“溶劑”
,減小“溶劑”![]() 和
和![]() 的極性,降低離子化合物
的極性,降低離子化合物![]() 的溶解度,有利于
的溶解度,有利于![]() 結晶析出;故答案為:加
結晶析出;故答案為:加![]() ,減小“溶劑”
,減小“溶劑”![]() 和
和![]() 的極性,降低離子化合物
的極性,降低離子化合物![]() 的溶解度;
的溶解度;
(4)![]() 晶體中,
晶體中,![]() 與SiCl4互為等電子體,所以呈正四面體的原子團是
與SiCl4互為等電子體,所以呈正四面體的原子團是![]() ,雜化軌道類型是
,雜化軌道類型是![]() 的原子,其價層電子對個數是4,有N原子、S原子和O原子,故答案為:
的原子,其價層電子對個數是4,有N原子、S原子和O原子,故答案為:![]() ;N、S、O。
;N、S、O。


科目:高中化學 來源: 題型:
【題目】如圖是三種酸對Fe-Cr合金隨Cr含量變化的腐蝕性實驗結果,下列有關說法正確的是( )

A.Cr含量小于13%時,因為三種酸中硫酸的氫離子濃度最大,所以對Fe-Cr合金的腐蝕性最強
B.Cr含量等于13%時,三種酸對Fe-Cr合金的腐蝕速率由快到慢的順序為H2SO4>HCl>HNO3
C.隨著Fe含量的增加,Fe-Cr合金在5%HNO3中的耐腐蝕性越來越弱
D.稀硫酸對Fe-Cr合金的腐蝕性比稀硝酸和稀鹽酸都強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2L的恒溫恒壓密閉容器中投入2molSO3發生反應:2SO3(s) ![]() 2SO2(g)+O2(g) △H= +akJ·mol-1(a>0),2min后達到平衡,此時SO2的物質的量為0.8mol,下列說法正確的是( )
2SO2(g)+O2(g) △H= +akJ·mol-1(a>0),2min后達到平衡,此時SO2的物質的量為0.8mol,下列說法正確的是( )
A.用SO3表示的反應速率為0.2mol·L-1·min-1
B.若O2的體積分數不變,證明該可逆反應已達平衡
C.在2min時,v正(SO2)=2v逆(O2)
D.平衡后,再投入2 mol SO3,則正反應速度加快,逆反應速率不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】描述 ![]() 分子結構的下列敘述中,正確的是
分子結構的下列敘述中,正確的是
A.6個碳原子有可能都在一條直線上B.6個碳原子一定都在同一平面上
C.6個碳原子不可能都在同一平面上D.所有原子有可能都在同一平面上
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業廢氣、汽車尾氣排放出的NOx、SO2等,是形成霧霾的主要物質,其綜合治理是當前重要的研究課題。
(1)已知:①CO燃燒熱的△H1=-283.0kJ·mol-l,②N2(g)+O2(g) ![]() 2NO(g) △H2=+180.5kJ·mol-1,汽車尾氣中的NO(g)和CO(g)在一定溫度和催化劑條件下可發生如下反應:2NO(g)+2CO(g)
2NO(g) △H2=+180.5kJ·mol-1,汽車尾氣中的NO(g)和CO(g)在一定溫度和催化劑條件下可發生如下反應:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g); △H=___。
N2(g)+2CO2(g); △H=___。
(2)將0.20mol NO和0.10molCO充入一個容積恒定為1L的密閉容器中發生上述反應,反應過程中部分物質的濃度變化如下圖所示.
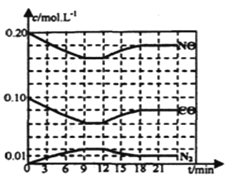
①該反應第一次達到平衡時的平衡常數為________。
②第12min時改變的條件是________。
③在第24min時,若保持溫度不變,再向容器中充入CO和N2各0.060mol,平衡將________移動(填“正向”、“逆向”或“不”).
(3)SNCR-SCR脫硝技術是一種新型的除去煙氣中氮氧化物的脫硝技術,一般采用氨氣或尿素。
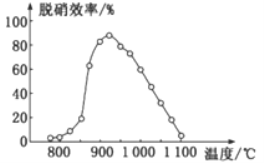
①SNCR脫硝技術中:在催化劑作用下用NH3作還原劑還原NO,其主要反應為:4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0。體系溫度直接影響SNCR技術的脫硝效率,如圖所示。當體系溫度約為925℃時,SNCR脫硝效率最高,其可能的原因是________。
②SCR脫硝技術中則用尿素[CO(NH2)2]作還原劑還原NO2的化學方程式為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】《hem Commun》報導,MarcelMayorl合成的橋連多環烴(![]() ),拓展了人工合成自然產物的技術。下列有關該烴的說法正確的是( )
),拓展了人工合成自然產物的技術。下列有關該烴的說法正確的是( )
A. 屬于飽和烴,常溫時為氣態B. 二氯代物共有5種
C. 分子中含有4個五元環D. 不存在屬于苯的同系物的同分異構體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學用語或物質的性質描述正確的是( )
A. 乙烯在一定條件下能發生加成反應,加聚反應,被酸性高錳酸鉀溶液氧化
B. 符合分子式為C3H8O的醇有三種不同結構
C. 如圖的鍵線式表示烴的名稱為:3-甲基-4-乙基-7-甲基辛烷![]()
D. 治療瘧疾的青蒿素(如圖)易溶于水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】容積固定的密閉容器中,達平衡的可逆反應2A(g)![]() 2B(?) + C (?)(△H>0),若隨著溫度升高,氣體平均相對分子質量減小,則下列判斷正確的是:( )
2B(?) + C (?)(△H>0),若隨著溫度升高,氣體平均相對分子質量減小,則下列判斷正確的是:( )
A. B和C可能都是液體 B. B和C肯定都是氣體
C. B和C可能都是固體 D. 若C為固體,則B一定是氣體。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知如下兩個熱化學反應
![]() (l)+H2(g)→
(l)+H2(g)→![]() (l)
(l)![]() H>0 ①
H>0 ①
![]() (l)+2H2(g)→
(l)+2H2(g)→![]() (l)
(l)![]() H<0 ②
H<0 ②
下列說法不正確的是
A.反應①、②都屬于加成反應
B.l,3一環己二烯比苯穩定
C.反應①、②的熱效應說明苯環中含有的并不是碳碳雙鍵
D.反應①、②中的所有有機物均可使溴水褪色,但褪色原理不完全相同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com