
 氨氣是重要的化工原料.
氨氣是重要的化工原料.| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
分析 (1)濃氨水與堿混合可制備氨氣;
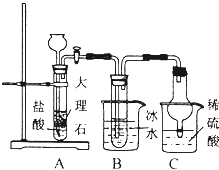
(2)由圖可知,A中碳酸鈣與鹽酸反應生成CO2,B裝置中的試管內是溶有氨和氯化鈉的溶液,且二者均已達到飽和,B中冰水可降低溫度,B中發生NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3,C中吸收過量的氨氣且可防止倒吸,該裝置中鹽酸易揮發,與碳酸氫鈉反應,結合NaCl~NaHCO3計算;
(3)[Cu(NH3)4]2+ (深藍色)+4H+?Cu2+(藍色)+4NH4+中氫離子濃度影響平衡移動,結合顏色變化分析.
解答 解:(1)燒堿、生石灰、堿石灰均與氨水混合可快速制備氨氣,而氯化銨與氨水混合不能制備氨氣,故答案為:abd;
(2)①C裝置的作用為防倒吸、吸收過量氨氣防污染,
故答案為:防倒吸、吸收過量氨氣防污染;
②由表格數據可知,B裝置中使用冰水的目的是低溫便于析出碳酸氫鈉,
故答案為:低溫便于析出碳酸氫鈉;
③鹽酸揮發干擾實驗,應除去HCl,則在AB裝置之間連接一個盛有飽和碳酸氫鈉溶液的洗氣瓶,其作用為 除去二氧化碳氣體中的氯化氫氣體,
故答案為:AB;飽和碳酸氫鈉溶液;除去二氧化碳氣體中的氯化氫氣體;
④由NaCl~NaHCO3可知,理論上生成NaHCO3為$\frac{11.7g}{58.5g/mol}$×84g/mol=16.8g,實驗后得到干燥NaHCO3晶體質量為10.92g,則NaHCO3的產率為$\frac{10.92g}{16.8g}$×100%=65%,故答案為:65%;
(3)實驗證明平衡I是否存在的方法為往深藍色溶液中通入少量HCl氣體若溶液顏色變淺,證明有平衡Ⅰ的存在,否則不存在(或通入少量氨氣或加少量NaOH固體,若溶液顏色變深證明平衡Ⅰ的存在,否則不存在),
故答案為:往深藍色溶液中通入少量HCl氣體若溶液顏色變淺,證明有平衡Ⅰ的存在,否則不存在(或通入少量氨氣或加少量NaOH固體,若溶液顏色變深證明平衡Ⅰ的存在,否則不存在).
點評 本題考查物質的制備實驗,為高頻考點,把握制備原理、實驗裝置的作用、混合物分離、實驗技能為解答的關鍵,注意(3)中平衡移動原理的應用,側重分析與實驗能力的考查,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 95℃純水的pH<7,說明加熱可導致水呈酸性 | |
| B. | 向水中加入少量稀硫酸,c(H+)增大,KW不變 | |
| C. | 向水中加入氨水,水的電離平衡向正反應方向移動,c(OH-)增大 | |
| D. | pH=3的醋酸溶液,稀釋至10倍后pH=4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
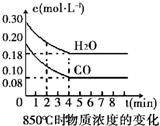
| 時間(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②③⑤⑦ | B. | ①②③⑥⑦ | C. | ①②④⑦ | D. | ②③⑤⑥⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
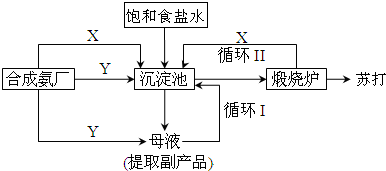
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
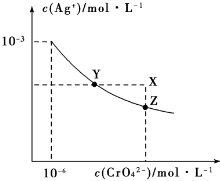 t℃時Ag2CrO4在水中的沉淀溶解平衡曲線如圖所示.下列說法正確的是( )
t℃時Ag2CrO4在水中的沉淀溶解平衡曲線如圖所示.下列說法正確的是( )| A. | 加熱蒸發飽和Ag2CrO4溶液再恢復到t℃,可使溶液由Y點變到Z點 | |
| B. | 在X點沒有Ag2CrO4沉淀生成,則此時溫度低于t℃ | |
| C. | 向飽和Ag2CrO4溶液中加入少量AgNO3固體,可使溶液由Z點到Y點 | |
| D. | 在t℃時,Ag2CrO4的Ksp為1×10-9 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,AgCl若要在NaI溶液中開始轉化為AgI,則NaI的濃度必須不低于$\frac{1}{\sqrt{1.8}}$×10-11 mol•L-1 | |
| B. | 向BaCl2溶液中加入AgNO3和KI,當兩種沉淀共存時,$\frac{c({I}^{-})}{c(C{l}^{-})}$=5.6×10-7 | |
| C. | AgI比AgCl更難溶于水,所以,AgCl可以轉化為AgI | |
| D. | AgCl不溶于水,不能轉化為AgI |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com