
| A. | 95℃純水的pH<7,說明加熱可導致水呈酸性 | |
| B. | 向水中加入少量稀硫酸,c(H+)增大,KW不變 | |
| C. | 向水中加入氨水,水的電離平衡向正反應方向移動,c(OH-)增大 | |
| D. | pH=3的醋酸溶液,稀釋至10倍后pH=4 |
分析 A.無論pH大小,純水都呈中性;
B.水中加入稀硫酸,c(H+)增大,離子積常數只與溫度有關;
C.向水中加入氨水,c(OH-)增大,抑制水電離;
D.醋酸是弱電解質,醋酸溶液中存在電離平衡.
解答 解:A.無論pH大小,純水都呈中性,95℃純水的pH<7,但純水仍然呈中性,故A錯誤;
B.水中加入稀硫酸,c(H+)增大,離子積常數只與溫度有關,溫度不變,水的離子積常數不變,故B正確;
C.向水中加入氨水,c(OH-)增大,抑制水電離,水的電離平衡逆向移動,故C錯誤;
D.醋酸是弱電解質,醋酸溶液中存在電離平衡,所以pH=3的醋酸溶液,稀釋至10倍后溶液中氫離子濃度大于原來的$\frac{1}{10}$,所以稀釋有溶液的pH<4,故D錯誤;
故選B.
點評 本題考查弱電解質的電離,為高頻考點,明確弱電解質電離特點、水電離影響因素是解本題關鍵,注意:離子積常數只與溫度有關,與溶液酸堿性及物質溶解性強弱無關,易錯選項是A.


 53天天練系列答案
53天天練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若將含0.6mol H2SO4的稀硫酸與含1mol NaOH的稀溶液混合,放出的熱量等于57.3 kJ | |
| B. | 已知正丁烷(g)→異丁烷(g)△H<0,則正丁烷比異丁烷穩定 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,則H2的燃燒熱為571.6 kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,則△H1>△H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增加C,B的平衡轉化率不變 | |
| B. | 此時,B的平衡轉化率是35% | |
| C. | 增大該體系的壓強,平衡向右移動,化學平衡常數增大 | |
| D. | 該反應的化學平衡常數表達式是K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C+H2O$\frac{\underline{\;高溫\;}}{\;}$CO+H2 | B. | Na2O+H2O═2NaOH | ||
| C. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | D. | 2H2O$\frac{\underline{\;電解\;}}{\;}$2H2↑+O2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 2:7或5:4 | B. | 2:1或5:4 | C. | 4:5或7:2 | D. | 2:1或7:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ②③④ | C. | ①③⑤ | D. | ②⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 molBr-完全轉化為BrO3-,得到6 mol電子 | |
| B. | 該過程中溴化物發生氧化反應,臭氧發生還原反應 | |
| C. | 該過程中溴元素被還原,氧元素被氧化 | |
| D. | 該過程中臭氧(O3)是氧化劑,溴酸鹽(BrO3-)是還原劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
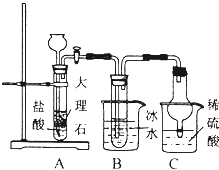 氨氣是重要的化工原料.
氨氣是重要的化工原料.| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com