
分析 (1)氯化銀的質量為0.287g,所以物質的量為:$\frac{0.287g}{143.5g/mol}$=0.002mol,所以氯氣的物質的量為$\frac{0.002mol}{2}$=0.001mol,則標況下的體積為0.0224L;
(2)反應生成氯化鈉和次氯酸鈉,根據氯守恒n(NaOH)=2n(Cl2)分析解答;
(3)Cl2過量,生成的I2會繼續這被氧化為IO3-,所以反應方程式為:3H2O+5Cl2+5I-=2I2+IO3-+10Cl-+6H+.
解答 解:(1)氯化銀的質量為0.287g,所以物質的量為:$\frac{0.287g}{143.5g/mol}$=0.002mol,所以氯氣的物質的量為$\frac{0.002mol}{2}$=0.001mol,則標況下的體積為0.0224L,所以該廢氣樣品中Cl2的體積分數為$\frac{0.0224L}{1.00L}×100%$=2.24%,故答案為:2.24%;
(2)n(NaOH)=0.001mol×2=0.02 mol,所以NaOH溶液的物質的量濃度為0.02 mol/L,故答案為:0.02 mol/L;
(3)Cl2過量,生成的I2會繼續這被氧化為IO3-,所以反應方程式為:3H2O+5Cl2+5I-=2I2+IO3-+10Cl-+6H+,則生成的I2和IO3-的物質的量之比為2:1,故答案為:2:1.
點評 本題考查了氧化還原反應型的離子方程式書寫,題目難度中等,明確反應物過量情況對生成物的影響為解答關鍵,注意掌握離子方程式的書寫原則.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
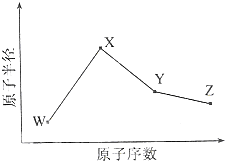 W、X、Y、Z是四種常見的短周期元素,其原子半徑隨原子序數變化如圖所示.已知W的一種核素的質量數為18,中子數為10;X和Ne原子的核外電子數相差1;Y的單質是一種常見的半導體材料;Z的電負性在同周期主族元素中最大.
W、X、Y、Z是四種常見的短周期元素,其原子半徑隨原子序數變化如圖所示.已知W的一種核素的質量數為18,中子數為10;X和Ne原子的核外電子數相差1;Y的單質是一種常見的半導體材料;Z的電負性在同周期主族元素中最大.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ax/100bmol/L | B. | ax/500bmol/L | C. | ax/2000bmol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 常溫常壓下,1.7gH2O2中含有的電子數為0.9nA | |
| B. | 1L1 mol.L-1CuCl2溶液含有2nA個Cl- | |
| C. | 1 mol Na 與足量 O2反應,生成Na2O和Na2O2的混合物,鈉失去2nA個電子 | |
| D. | 標準狀況下,2.24L戊烷所含分子數為0.1nA |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2 H2O2$\frac{\underline{\;催化劑\;}}{\;}$2 H2O+O2↑ | B. | 2 Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3 H2O | ||
| C. | Fe2O3+3 CO$\frac{\underline{\;高溫\;}}{\;}$2 Fe+3 CO2 | D. | Cl2+H2O═HCl+HclO |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com