
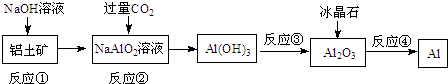
| A. | 流程中涉及的反應均為非氧化還原反應 | |
| B. | 反應②產生的陰離子主要為CO32- | |
| C. | 實驗室中完成反應③應在蒸發皿中進行 | |
| D. | 反應①中發生的主要反應為:Al2O3+2OH-=2AlO2-+H2O |
分析 由實驗流程可知,①中鋁土礦中氧化鋁與NaOH發生反應生成偏鋁酸鈉和水,②通入過量CO2發生反應CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓,過濾后氫氧化鋁分解生成氧化鋁,最后電解氧化鋁生成Al,以此來解答.
解答 解:由實驗流程可知,①中鋁土礦中氧化鋁與NaOH發生反應生成偏鋁酸鈉和水,②通入過量CO2發生反應CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓,過濾后氫氧化鋁分解生成氧化鋁,最后電解氧化鋁生成Al,
A.電解熔融Al2O3的反應屬于氧化還原反應,反應的方程式為2Al2O3(熔融)$\frac{\underline{\;冰晶石\;}}{電解}$4Al+3O2↑,屬于氧化還原反應,故A錯誤;
B.②通入過量CO2發生反應CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓,陰離子主要為HCO3-,故B錯誤;
C.反應③為加熱分解氫氧化鋁固體應在坩堝中進行,故C錯誤;
D.①中鋁土礦中氧化鋁與NaOH發生反應生成偏鋁酸鈉和水,離子方程式為Al2O3+2OH-=2AlO2-+H2O,故D正確.
故選D.
點評 本題考查物質的分離、提純,為高頻考點,側重于學生的分析、實驗能力的考查,注意把握流程中的反應、物質的性質的異同及混合物分離方法,題目難度不大.


 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案 綜合自測系列答案
綜合自測系列答案科目:高中化學 來源: 題型:選擇題
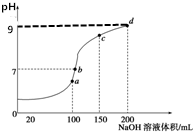 室溫時,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH值與NaOH溶液體積的關系曲線如圖所示(忽略溶液混合時的體積變化),下列判斷不正確的是( )
室溫時,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH值與NaOH溶液體積的關系曲線如圖所示(忽略溶液混合時的體積變化),下列判斷不正確的是( )| A. | a點所示的溶液中:c(Na+)=c(SO42-)>c(NH4+) | |
| B. | b點所示的溶液中:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| C. | c點所示的溶液中:c(Na+)+c(NH4+)=2c(SO42-) | |
| D. | d點所示的溶液中:c(NH4+)+10-9mol•L-1=$\frac{{K}_{w}}{1{0}^{-9}}$mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鋁是一種重要的金屬,在生產、生活中具有許多重要的用途,如圖是從鋁土礦中制各鋁的工藝流程:
鋁是一種重要的金屬,在生產、生活中具有許多重要的用途,如圖是從鋁土礦中制各鋁的工藝流程:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 弱酸 | HCOOH | HCN | H2CO3 |
| 電離平衡常數 ( 25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 向NaCN溶液中通入少量的CO2發生的離子反應為:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 處理含CN-廢水時,如用NaOH溶液調節pH至9,此時c(CN-)<c(HCN) | |
| C. | 中和等體積、等pH的HCOOH溶液和HCN溶液消耗NaOH的物質的量前者小于后者 | |
| D. | 等體積、等物質的量濃度的HCOONa和NaCN溶液中所含離子總數前者大于后者 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 往溶液中加入適量的氫氧化鈉,使溶液中c(Na+)=c(CH3 COO-) | |
| B. | 將溶液與10 mLpH=10的NaOH溶液混合 | |
| C. | 將溶液與10 mL濃度為a mol•L-1的NaOH溶液混合 | |
| D. | 將溶液稀釋到10 L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 常溫下,取濃度均為0.01mol•L-1的HA溶液和MOH溶液各20mL,分別用0.01mol•L-1NaOH溶液、0.01mol•L-1鹽酸進行中和滴定,滴定過程中pH隨滴加溶液的體積變化關系如圖所示.下列說法正確的是( )
常溫下,取濃度均為0.01mol•L-1的HA溶液和MOH溶液各20mL,分別用0.01mol•L-1NaOH溶液、0.01mol•L-1鹽酸進行中和滴定,滴定過程中pH隨滴加溶液的體積變化關系如圖所示.下列說法正確的是( )| A. | HA和MOH均為弱電解質 | |
| B. | 曲線a中,滴加溶液到20mL時,c(Cl-)=c(M+)=c(OH-)=c(H+) | |
| C. | 曲線b中,滴加溶液到20mL時,c(Na+)>c(A-)>c(OH-)>c(H+) | |
| D. | 曲線b中,滴加溶液到10mL時,c(A-)+c(OH-)=c(H+)+c(HA) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 開始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com