
【題目】某元素構成的雙原子單質分子有3種,其分子量分別為158、160、162。在天然單質中,此三種單質的物質的量之比為1︰1︰1,由此推斷的以下結論中,正確的是( )
A.此元素有三種同位素
B.其中質量數為79的同位素原子占原子總數的1/2
C.其中一種同位素的質量數為80
D.此元素的單質的平均分子量為160
【答案】BD
【解析】
某元素構成的雙原子單質分子有3種,其分子量分別為158、160、162,說明該元素有2種同位素,158 是最小的分子量,必然是由質量數小的2個同位素原子構成的;162 是最大的分子量,則必然是由質量數大的2個同位素原子構成的;分子量分別為160的分子由兩種同位素的各一個原子構成。則該元素兩種同位素原子的質量數分別是79、81;3種單質分子可表示為![]() 、
、![]() 、
、![]() 。
。
A. 此元素有兩種同位素,質量數分別是79、81,故A錯誤;
B. ![]() 、
、![]() 、
、![]() 物質的量之比為1︰1︰1,屬于質量數為79的同位素原子占原子總數的1/2,故B正確;
物質的量之比為1︰1︰1,屬于質量數為79的同位素原子占原子總數的1/2,故B正確;
C. 該元素有2種同位素,兩種同位素原子的質量數分別是79、81,故C錯誤;
D. ![]() 、
、![]() 、
、![]() 物質的量之比為1︰1︰1,此元素的單質的平均分子量為
物質的量之比為1︰1︰1,此元素的單質的平均分子量為![]() 160,故D正確;
160,故D正確;
選BD。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】某化學課外小組用圖裝置制取溴苯。先向分液漏斗中加入苯和液溴,再將混合液慢慢滴入反應器A(A下端活塞關閉)中。
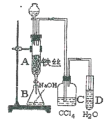
(1)寫出A中反應的化學方程式_______________。
(2)觀察到A中的現象是_____________________。
(3)實驗結束時,打開A下端的活塞,讓反應液流入B中,充分振蕩,目的是________,寫出有關的化學方程式______________________________。
(4)C中盛放CCl4的作用是________________。
(5)能證明苯和液溴發生的是取代反應,而不是加成反應,可向試管D中加入AgNO3溶液,若產生淡黃色沉淀,則能證明。另一種驗證的方法是向試管D中加入_______,現象是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2SO2(g)+O2(g)![]() 2SO3(g)反應過程的能量變化如圖所示。請回答下列問題:
2SO3(g)反應過程的能量變化如圖所示。請回答下列問題:
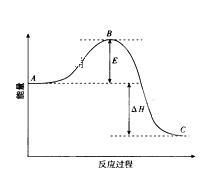
(1)該反應通常用V2O5作催化劑加快反應的進行,加V2O5會使圖中B點______(填“升高”或“降低”)。
(2)E的大小對該反應的反應熱有無影響_______。
(3)圖中A表示SO2(g)和O2(g)的_________。
(4)圖中△H的意義是__________。
(5)V2O5的催化循環機理可能為:V2O5氧化SO2時,自身被還原為四價釩化合物,四價釩化合物再被氧氣氧化。寫出該催化過程實際發生反應的化學方程式_____,_____;
(6)如果反應速率υ(SO2)為0.05 mol·L-1·min-1,則υ(O2)=________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有一種酸式鹽AHB,它的水溶液顯弱堿性,今有下列說法,其中正確的是
A.相同溫度相同濃度的AOH溶液和H2B溶液,電離程度前者大于后者
B.HB—的電離程度大于HB—的水解程度
C.該鹽的電離方程式為AHB=A++H++B2—
D.在溶液中離子濃度大小順序一般為:c(A+)>c(OH—)>c(HB—)>c(B2—)>c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】t℃時Ag2CrO4在水中的沉淀溶解平衡曲線如圖所示。下列說法正確的是
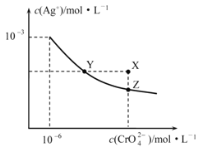
A.在t℃時,Ag2CrO4的Ksp=1×10-9
B.X點有Ag2CrO4沉淀生成
C.通過加熱蒸發并恢復到t℃時可以使溶液由Y點變到Z點
D.在飽和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y點變到X點最終變到Z點
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】標準狀況下的aLHCl(g)溶于1000g水中,得到的鹽酸密度為bg·cm-3,則該鹽酸的物質的量濃度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某探究性學習小組欲用酸堿中和滴定法測定市售白醋的總酸量(g·100mL-1)。有關操作如下:
Ⅰ.實驗步驟
(1)用________(填儀器名稱)量取10.00mL食用白醋,在燒杯中用水稀釋后轉移到100mL容量瓶中定容,搖勻即得待測白醋溶液。
(2)用酸式滴定管取待測白醋溶液20.00mL于錐形瓶中,向其中滴加2滴________作指示劑。
(3)讀取盛裝0.1000mol·L-1NaOH溶液的堿式滴定管的初始讀數。如果液面位置如圖所示,則此時的讀數為________mL。
![]()
(4)滴定。當__________________________________________________時,停止滴定,并記錄NaOH溶液的終讀數。重復滴定3次。
Ⅱ.實驗記錄
滴定次數實驗數據(mL) | 1 | 2 | 3 | 4 |
V(樣品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.數據處理與討論
(1)處理數據可得:c(市售白醋)=________mol·L-1;市售白醋總酸量=________g·100mL-1。
(2)在本實驗的滴定過程中,下列操作會使實驗結果偏大的是________填寫序號)。
a.堿式滴定管在滴定時未用標準NaOH溶液潤洗
b.堿式滴定管的尖嘴在滴定前有氣泡,滴定后氣泡消失
c.錐形瓶中加入待測白醋溶液后,再加少量水
d.錐形瓶在滴定時劇烈搖動,有少量液體濺出
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示是工業生產硝酸銨的流程。
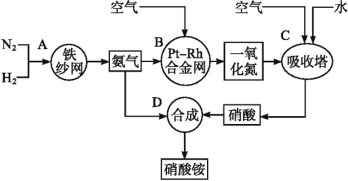
(1)寫出N2和H2通過紅熱的鐵紗網生成氨氣的反應方程式:__。
(2)B裝置中Pt-Rh合金網的作用是__,寫出B中有關反應方程式:__。
(3)寫出D中反應方程式:___。
(4)吸收塔C中通入空氣的目的是___。A、B、C、D四個容器中的反應,屬于氧化還原反應的是__(填字母)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨法溶浸氧化鋅煙灰制取高純鋅的工藝流程如圖所示。溶浸后氧化鋅煙灰中鋅、銅、鎘、砷元素分別以![]() 、
、![]() 、
、![]() 、
、![]() 的形式存在。
的形式存在。
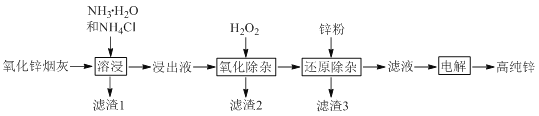
回答下列問題:
![]() 中Zn的化合價為_______,“溶浸”中ZnO發生反應的離子方程式為_______。
中Zn的化合價為_______,“溶浸”中ZnO發生反應的離子方程式為_______。
![]() 鋅浸出率與溫度的關系如圖所示,分析
鋅浸出率與溫度的關系如圖所示,分析![]() 時鋅浸出率最高的原因為_______。
時鋅浸出率最高的原因為_______。

![]() “氧化除雜”中,
“氧化除雜”中,![]() 轉化為
轉化為![]() 膠體吸附聚沉除去,溶液始終接近中性。該反應的離子方程式為_______。
膠體吸附聚沉除去,溶液始終接近中性。該反應的離子方程式為_______。
![]() “濾渣3”的主要成分為_______。
“濾渣3”的主要成分為_______。
![]() “電解”時
“電解”時![]() 在陰極放電的電極反應式為______。陽極區放出一種無色無味的氣體,將其通入滴有KSCN的
在陰極放電的電極反應式為______。陽極區放出一種無色無味的氣體,將其通入滴有KSCN的![]() 溶液中,無明顯現象,該氣體是_______
溶液中,無明顯現象,該氣體是_______![]() 寫化學式
寫化學式![]() 。電解后的電解液經補充_______
。電解后的電解液經補充_______![]() 寫一種物質的化學式
寫一種物質的化學式![]() 后可返回“溶浸”工序繼續使用。
后可返回“溶浸”工序繼續使用。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com