
| A. | 金屬鈉可以從四氯化鈦溶液中置換出金屬鈦 | |
| B. | 工業制備和提純硅的三步化學反應都是氧化還原反應 | |
| C. | 鎂的提取中將氯化鎂溶液蒸發結晶可直接獲得無水氯化鎂,電解熔融無水氯化鎂得到金屬鎂 | |
| D. | 硫酸的工業制法中,依次使用的三種設備是沸騰爐,接觸室,吸收塔 |
分析 A、鈉與四氯化鈦溶液反應時置換出氫氣,不會生成鈦;
B、①SiO2+2C$\frac{\underline{\;高溫\;}}{\;}$Si+2CO↑,反應前后有元素化合價變化; ②Si+2Cl2$\frac{\underline{\;高溫\;}}{\;}$SiCl4 反應前后有化合價變化; ③SiCl4+2H2$\frac{\underline{\;高溫\;}}{\;}$Si+4HCl,反應前后有元素化合價變化;
C、氯化鎂是強酸弱堿鹽,蒸發結晶得到氫氧化鎂;
D、根據工業制硫酸的三設備:沸騰爐、接觸室和吸收塔.
解答 解:A、鈉與四氯化鈦溶液反應時,鈉優先與水反應,不會置換出金屬鈦,而是鈉與熔融的四氯化鈦反應生成單質鈦,故A錯誤;
B、①SiO2+2C$\frac{\underline{\;高溫\;}}{\;}$Si+2CO↑,反應前后有元素化合價變化; ②Si+2Cl2$\frac{\underline{\;高溫\;}}{\;}$SiCl4 反應前后有化合價變化; ③SiCl4+2H2$\frac{\underline{\;高溫\;}}{\;}$Si+4HCl,反應前后有元素化合價變化,所以都是氧化還原反應,故B正確;
C、氯化鎂是強酸弱堿鹽,蒸發結晶得到氫氧化鎂,所以在氯化氫的氛圍中蒸發結晶可直接獲得無水氯化鎂,故C錯誤;
D、工業制硫酸的三設備是:沸騰爐、接觸室和吸收塔,故D正確;
故選BD.
點評 本題考查了海水資源的開發和利用,涉及金屬的冶煉氧化還原反應等知識點,根據金屬的活動性強弱與冶煉方法的選取、電解原理、物質的性質等知識點來分析解答,注意由帶結晶水的氯化鎂制取氯化鎂的條件,為易錯點.


科目:高中化學 來源: 題型:選擇題
| 加入的物質 | 結論 | |
| A. | 100 mL 0.1 mol/L鹽酸 | 溶液中2c=c(Cl-) |
| B. | 0.01 mol Na2O2固體 | 反應完全后,溶液pH增大,c(Na+)=2c(Cl-) |
| C. | 100 mL H2O | 由水電離出的c(H+)•c(OH-)不變 |
| D. | 100 mL 0.1 mol/L NH3•H2O | 溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$減小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
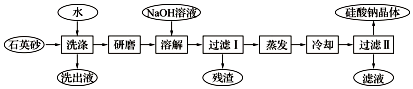
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 熱穩定性:Na2CO3>NaHCO3 | |
| B. | 相同溫度下,0.1mol•L-1鹽溶液的pH值:Na2CO3>NaHCO3 | |
| C. | 等質量的碳酸鈉和碳酸氫鈉分別與足量鹽酸反應放出氣體的量:Na2CO3<NaHCO3 | |
| D. | 相同溫度下,0.1mol•L-1鹽溶液分別與0.1mol•L-1HCl反應的劇烈程度:Na2CO3>NaHCO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
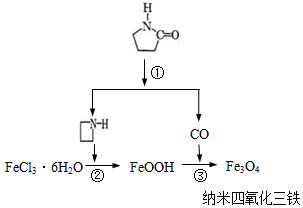 納米Fe3O4晶體材料可以作為核磁共振造影增強劑,用于疾病的診斷和治療.其制備過程如圖所示、下列敘述不合理的是( )
納米Fe3O4晶體材料可以作為核磁共振造影增強劑,用于疾病的診斷和治療.其制備過程如圖所示、下列敘述不合理的是( )| A. | 在反應②中,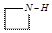 的作用可能是促進氯化鐵水解 的作用可能是促進氯化鐵水解 | |
| B. | 反應③的化學方程式是:6FeOOH+CO═2Fe3O4+3H2O+CO2 | |
| C. | 直接加熱FeCl3溶液也可以得到四氧化三鐵 | |
| D. | 納米四氧化三鐵形成的分散劑,有可能產生丁達爾現象 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| W | X | ||
| Y | Z |
| A. | Z元素的最高價氧化物水化物的酸性強于Y | |
| B. | 由W元素形成的分子W2中存在三個共價鍵 | |
| C. | 四種元素常見的氫化物:YH4、WH3、H2X、HZ中,YH4最穩定 | |
| D. | 氫化物WH3與HZ反應生成的離子化合物中存在10e-、18 e-兩種微粒 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
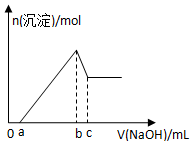 某無色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、Cl-、SO42-、NO3-中的幾種,取該溶液三等份分別進行實驗①加入少量Zn產生H2,②逐滴加入NaOH溶液,其加入量和沉淀生成量關系如圖所示,③加入0.1mol/LBaCl2溶液至5ml時不再產生白色沉淀,取上層清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )
某無色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、Cl-、SO42-、NO3-中的幾種,取該溶液三等份分別進行實驗①加入少量Zn產生H2,②逐滴加入NaOH溶液,其加入量和沉淀生成量關系如圖所示,③加入0.1mol/LBaCl2溶液至5ml時不再產生白色沉淀,取上層清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )| A. | 一定沒有NO3- | B. | 可能有K+、NO3-、SO42- | ||
| C. | 不能確定是否含有K+、NO3- | D. | 一定有Mg2+、Al3+、Cl-、SO42- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com