

| c(N2O4) |
| c2(NO2) |
| 0.0480 |
| 0.06002 |
| 0.0600mol×1+0.048mol×2 |
| 2 |


 星級口算天天練系列答案
星級口算天天練系列答案 芒果教輔達標測試卷系列答案
芒果教輔達標測試卷系列答案科目:高中化學 來源: 題型:
| A、0.1mol/L的 NaHCO3溶液中:c (Na+)+c (H+)+C(H2CO3)=c (HCO3-)+c(CO32-)+c (OH-) |
| B、等體積、等物質的量濃度的NaX和弱酸HX混合后的溶液中:C(Na+)>C(HX)>C(X-)>C(H+)>C(OH-) |
| C、在純堿溶液中存在:C(OH-)=C(H+)+C(HCO3-)+2C(H2CO3) |
| D、0.1mol/L HCOOH溶液中:C(HCOO-)+C(OH-)=C(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:
 2013年初,全國各地多個城市都遭遇“十面霾伏”,造成“陰霾天”的主要根源之一是汽車尾氣和燃煤尾氣排放出來的固體小顆粒.
2013年初,全國各地多個城市都遭遇“十面霾伏”,造成“陰霾天”的主要根源之一是汽車尾氣和燃煤尾氣排放出來的固體小顆粒.| 催化劑 |
| 時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/xl0-4mol L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/xl0-3mol L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

查看答案和解析>>
科目:高中化學 來源: 題型:
 右圖是銅與稀硝酸反應的實驗裝置圖,請回答下列問題:
右圖是銅與稀硝酸反應的實驗裝置圖,請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| 條件的變化 | 通氨氣 | 加水 | 加NH4Cl(s) | |
| ① | 電離平衡移動的方向 | |||
| ② | c(OH-)的變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
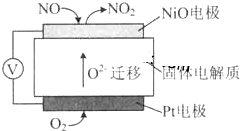
| A、NiO電極是該電池的正極 |
| B、Pt電極附近的pH增大 |
| C、NiO電極的電極反應式:NO-2e-+O2-═NO2 |
| D、固體電解質中O2-向正極移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、氨氣通入醋酸溶液中:NH3+H+=NH4+ | ||||
| B、碳酸氫鋇溶液中加入過量氫氧化鈉溶液:Ba2++HCO3-+OH-=BaCO3↓+H2O | ||||
| C、硫酸亞鐵酸性溶液中加入過氧化氫:2Fe2++2H++H2O2=2Fe3++2H2O | ||||
D、用惰性電極電解硫酸銅溶液:Cu2++2H+
|
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com