

分析 (1)根據反應“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”分析,在反應中,Cu被氧化,失電子,應為原電池的負極,電極反應為Cu-2e-=Cu2+,則正極為活潑性較Cu弱的Ag,Ag+在正極上得電子被還原,電極反應為Ag++e=Ag,電解質溶液為AgNO3 ,原電池中,電子從負極經外電路流向正極,由此分析解答;
(2)①若電解質溶液為氯化鈉溶液,則乙中為電解氯化鈉溶液,陽極氯離子失電子,陰極氫離子得電子;
②根據得失電子數相等確定生成物,再根據反應物和生成物寫出反應方程式;
③若乙池的電源連接方向開始時就與上述的圖示相反,則Fe為陽極,失去電子,陰極氫離子放電生成氫氣和氫氧根離子.
解答 解:(1)①由反應“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反應中,Cu被氧化,失電子,應為原電池的負極,Ag+在正極上得電子被還原,電解質溶液為AgNO3 ,
故答案為:Cu;AgNO3;
②正極為活潑性較Cu弱的Ag,Ag+在正極上得電子被還原,電極反應為Ag++e=Ag,
故答案為:正; Ag++e=Ag;
③鹽橋中裝有含瓊膠的KNO3 飽和溶液,則鹽橋中陽離子向正極移動,K+向AgNO3溶液移動,即向B燒杯中移動,
故答案為:B;
(2)①若電解質溶液為氯化鈉溶液,則乙中為電解氯化鈉溶液,陽極氯離子失電子,陰極氫離子得電子,則總反應的離子方程式為:2Cl-+2H2O$\frac{\underline{\;通電\;}}{\;}$2OH-+H2↑+Cl2↑;故答案為:2Cl-+2H2O$\frac{\underline{\;通電\;}}{\;}$2OH-+H2↑+Cl2↑;
②過量的Cl2將生成的I2又氧化,氯氣被還原生成氯離子,1mol氯氣被還原得到2mol電子,若反應的Cl2和I2物質的量之比為5:1,且生成兩種酸,根據得失電子數相等知,含碘的酸中碘的化合價是+5價,所以含碘的酸是碘酸,故氯氣和碘、水反應生成鹽酸和碘酸,反應方程式為:5Cl2+I2+6H2O=2HIO3+10HCl,
故答案為:5Cl2+I2+6H2O=2HIO3+10HCl;
③若乙池的電源連接方向開始時就與上述的圖示相反,則Fe為陽極,失去電子,陰極氫離子放電生成氫氣,生成的亞鐵離子與氫氧根離子反應生成氫氧化亞鐵,觀察到產生白色沉淀,
故答案為:產生白色沉淀.
點評 本題考查原電池的設計及工作原理、電解原理的應用等,題目難度中等,注意電極反應式的書寫方法,牢固掌握原電池中電極的判斷,電極反應式的書寫的方法等問題.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 物質A的轉化率增大了 | B. | 平衡向正反應方向移動 | ||
| C. | 物質C的體積分數增大了 | D. | a+b<c |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
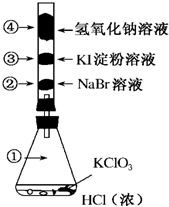 已知常溫下氯酸鉀與濃鹽酸反應放出氯氣,現按如圖進行氯、溴、碘的性質實驗.玻璃管內裝有分別滴有不同溶液的白色棉球,反應一段時間后,對圖中指定部位顏色描述正確的是( )
已知常溫下氯酸鉀與濃鹽酸反應放出氯氣,現按如圖進行氯、溴、碘的性質實驗.玻璃管內裝有分別滴有不同溶液的白色棉球,反應一段時間后,對圖中指定部位顏色描述正確的是( )| A. | ①黃綠色 ②橙色 ③藍色 ④白色 | B. | ①無色 ②橙色 ③紫色 ④白色 | ||
| C. | ①黃綠色 ②橙色 ③藍色 ④無色 | D. | ①黃綠色 ②無色 ③紫色 ④白色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 摩爾質量 | B. | 密度 | C. | 分子總數 | D. | 質量 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
 工業上用CO和H2生產燃料甲醇.一定條件下密閉容器中發生反應,測得數據曲線如圖所示(反應混合物均呈氣態).下列說法錯誤的是( )
工業上用CO和H2生產燃料甲醇.一定條件下密閉容器中發生反應,測得數據曲線如圖所示(反應混合物均呈氣態).下列說法錯誤的是( )| A. | 反應的化學方程式:CO+2H2?CH3OH | |
| B. | 反應進行至3分鐘時,正、逆反應速率相等 | |
| C. | 反應至10分鐘,?(CO)=0.075 mol/L•min | |
| D. | 增大壓強,平衡正向移動,K增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
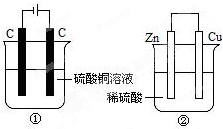 如圖兩個裝置中,液體體積均為200ml,開始時電解質溶液的濃度均為0.1mol/L,工作一段時間后,測得導線上都通過了0.02mole-,若不考慮溶液體積的變化,下列敘述正確的是( )
如圖兩個裝置中,液體體積均為200ml,開始時電解質溶液的濃度均為0.1mol/L,工作一段時間后,測得導線上都通過了0.02mole-,若不考慮溶液體積的變化,下列敘述正確的是( )| A. | 產生氣體體積①=② | |
| B. | 溶液的pH變化:①減小②增大 | |
| C. | 電極上析出固體質量①<② | |
| D. | 電極反應式:①中陽極:Cu2++2e-═Cu②中負極Zn-2e-═Zn2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 熔融鹽燃料電池具有高的發電效率,因而受到重視,可用Li2CO3和Na2CO3的熔融鹽混合物作電解質,CO為陽極燃氣,空氣與CO2的混和氣為陰極助燃氣,制得在650℃下工作的燃料電池,已知其電池反應相當于CO的燃燒,且負極反應式為2CO+2CO32--4e-=4CO2
熔融鹽燃料電池具有高的發電效率,因而受到重視,可用Li2CO3和Na2CO3的熔融鹽混合物作電解質,CO為陽極燃氣,空氣與CO2的混和氣為陰極助燃氣,制得在650℃下工作的燃料電池,已知其電池反應相當于CO的燃燒,且負極反應式為2CO+2CO32--4e-=4CO2查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com