

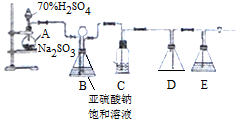
分析 (1)依據工業制硫酸的原理分析書寫化學方程式;
(2)根據工業制硫酸的步驟和設備名稱,結合實驗裝置的反應過程分析解答;
(3)O2和SO2在催化劑表面所發生反應,溫度影響反應速率、化學平衡和催化劑的活性;
(4)觀察甲裝置導管的冒泡速率進行估算通入乙中O2和SO2的量;
(5)若丁裝置在反應過程中先出現氣泡,不久就出現了霧,而丙裝置一直都沒有任何現象,可能是SO3通入丙和丁裝置中,丙中全部被吸收,丁中三氧化硫與水反應放出大量熱,形成酸霧;或者丙中壓強大,氣體直接進入丁中.
解答 解:(1)沸騰爐內煅燒黃鐵礦,反應物為FeS2和O2,生成物為Fe2O3和SO2,根據化合價升降法配平,FeS2中Fe由+2價變為+3價,S由-1價變為+4價,1molFeS2總共失去11mol電子,O2中O由O價變為為-2價,得4mol電子,所以FeS2前計量數為4,O2前計量數為11,再根據原子守恒其它物質的系數,化學方程式為4FeS2+11O2$\frac{\underline{\;高溫\;}}{\;}$2Fe2O3+8SO2;
故答案為:4FeS2+11O2$\frac{\underline{\;高溫\;}}{\;}$2Fe2O3+8SO2;
(2)在裝置乙中二氧化硫和氧氣發生催化氧化,所以裝置乙相當于接觸室;丙在實驗中是用來吸收二氧化硫的,所以相當于吸收塔;故答案為:接觸室、吸收塔;
故答案為:接觸室;吸收塔;
(3)O2和SO2在催化劑表面所發生反應,生成SO3,化學方程式為:2SO2+O2$?_{△}^{催化劑}$2SO3;該反應是放熱反應,溫度升高加快反應速率,但平衡逆向移動,使得SO2轉化率降低,且催化劑在一定溫度內活性最大,溫度過高會使催化劑喪失活性;
故答案為:2SO2+O2$?_{△}^{催化劑}$2SO3;
該反應為放熱反應,溫度升高SO2轉化率降低;溫度過高催化劑活性降低;
(4)乙反應容器內要求氧氣的量要比二氧化硫的量多一倍左右,要求氧氣進入裝置中的速度比二氧化硫進入裝置中的速度快一倍左右,故可以通過調節氣閥,控制氣體流量,即觀察甲裝置的冒泡速率進行估算;
故答案為:可以通過調節氣閥,控制氣體流量,觀察甲裝置的冒泡速率進行估算;
(5)若丁裝置在反應過程中先出現氣泡,不久就出現了霧,而丙裝置一直都沒有任何現象,可能是SO3通入丙和丁裝置中,丙中全部被吸收,丁中三氧化硫與水反應放出大量熱,形成酸霧;或者丙中壓強大,氣體直接進入丁中,即丙中的導氣管插得太深,導致兩個吸收瓶內的氣壓差較大;
故答案為:AC.
點評 本題主要考查工業接觸法制硫酸的原理,同時涉及到平衡移動、轉化率等,重點考查制備過程中的注意問題和條件的選擇依據,注重對知識的綜合運用和遷移能力考查,難度中等.


 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案科目:高中化學 來源: 題型:解答題

 ;G的結構簡式HCOOCH3;
;G的結構簡式HCOOCH3; .寫出D與C反應生成A的化學方程式CH3OH+
.寫出D與C反應生成A的化學方程式CH3OH+ $?_{△}^{濃硫酸}$
$?_{△}^{濃硫酸}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 物質 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 開始沉淀pH | 4.7 | 7.5 | 1.4 |
| 沉淀完全pH | 6.7 | 14 | 3.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | XO3- | B. | XO32- | C. | XO42- | D. | XO43- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 熱穩定性:HF>HCl>HBr>HI | B. | 微粒半徑:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 熔點:金剛石>Hg>KCl>HCl |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
 同一短周期內主族元素最高價氧化物對應水化物相同濃度稀溶液的pH與原子半徑的關系如圖,下列說法正確的是( )
同一短周期內主族元素最高價氧化物對應水化物相同濃度稀溶液的pH與原子半徑的關系如圖,下列說法正確的是( )| A. | 原子序數:W>Z>X | |
| B. | 氣態氫化物的穩定性:N>R | |
| C. | Y和W形成共價化合物 | |
| D. | X和Z兩者最高價氧化物對應的水化物能相互反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com