
| A. | Cu與Cu20的物質的量之比為2:1 | |
| B. | 硝酸的物質的量濃度為2.4mol/L | |
| C. | 產生的NO在標準狀況下的體枳為4.48L | |
| D. | Cu、Cu20與硝酸反應后剩余HN03為lmol |
分析 在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此時溶液呈中性,金屬離子已完全沉淀,溶液中溶質為NaNO3,n(NaNO3)=n(NaOH)=1.0mol/L×1.0L=1mol,沉淀為Cu(OH)2,質量為39.2g,物質的量為$\frac{39.2g}{98g/mol}$=0.4mol,根據銅元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],所以反應后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.4mol,
A.Cu和Cu2O的物質的量分別為xmol、ymol,根據二者質量及關系式n(Cu)+2n(Cu2O)=n[Cu(OH)2],列方程計算;
B.根據N元素守恒可知原硝酸溶液n(HNO3)=n(NO)+n(NaNO3),根據A計算的Cu和Cu2O的物質的量,利用電子轉移守恒計算n(NO),根據Na元素可知n(NaNO3)=n(NaOH),再根據c=$\frac{n}{V}$計算;
C.根據A計算的Cu和Cu2O的物質的量,利用電子轉移守恒計算n(NO),再根據V=nVm計算NO的體積;
D.反應后的溶液中加入氫氧化鈉溶液,氫氧化鈉與硝酸銅反應,剩余的氫氧化鈉與硝酸反應,最后為硝酸鈉溶液,根據氮元素守恒可知反應后溶液中n(HNO3)+2n[[Cu(NO3)2]=n(NaNO3),據此進行計算.
解答 解:在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此時溶液呈中性,金屬離子已完全沉淀,溶液中溶質為NaNO3,n(NaNO3)=n(NaOH)=1.0mol/L×1.0L=1mol,沉淀為Cu(OH)2,質量為39.2g,物質的量為$\frac{39.2g}{98g/mol}$=0.4mol,根據銅元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],所以反應后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.4mol,
A、設Cu和Cu2O的物質的量分別為xmol、ymol,根據二者質量有 64x+144y=27.2,根據銅元素守恒有x+2y=0.4,聯立方程解得x=0.2,y=0.1,所以n(Cu):n(Cu2O)=0.2:0.1=2:1,故A正確;
B、根據N元素守恒可知n(HNO3)=n(NO)+n(NaNO3),根據電子轉移守恒可知:3n(NO)=2n(Cu)+2n(Cu2O),所以3n(NO)=2×0.2mol+2×0.1mol,解得n(NO)=0.2mol,根據Na元素可知n(NaNO3)=n(NaOH)=1.0mol/L×1.0L=1mol,所以n(HNO3)=n(NO)+n(NaNO3)=0.2mol+1mol=1.2mol,所以原硝酸溶液的濃度為$\frac{1.2mol}{0.5L}$=2.4mol/L,故B正確;
C、由B中計算可知n(NO)=0.2mol,所以標準狀況下NO的體積為0.2mol×22.4L/mol=4.48L,故C正確;
D、反應后的溶液中加入氫氧化鈉溶液,氫氧化鈉與硝酸銅反應,剩余的氫氧化鈉與硝酸反應,最后為硝酸鈉溶液,根據氮元素守恒可知反應后溶液中n(HNO3)+2n[[Cu(NO3)2]=n(NaNO3),所以n(HNO3)=n(NaNO3)-2n[[Cu(NO3)2]=1mol-2×0.4mol=0.2mol,故D錯誤;
故選D.
點評 本題考查銅及其化合物知識、氧化還原反應的計算,難度較大,清楚反應過程,充分利用守恒計算是解題的關鍵,試題培養了學生的化學計算能力.


 開心快樂假期作業暑假作業西安出版社系列答案
開心快樂假期作業暑假作業西安出版社系列答案科目:高中化學 來源: 題型:選擇題
 將鎂條、鋁條平行插入盛有一定濃度的NaOH溶液的燒杯中,用導線和電流表連接成原電池,裝置如圖所示.此電池工作時,下列敘述正確的是( )
將鎂條、鋁條平行插入盛有一定濃度的NaOH溶液的燒杯中,用導線和電流表連接成原電池,裝置如圖所示.此電池工作時,下列敘述正確的是( )| A. | Mg比Al活潑,Mg失去電子被氧化成Mg2+ | |
| B. | 每生成1molH2,有2mol H2O被還原 | |
| C. | 該電池的內外電路中,電流均是由電子定向移動形成的 | |
| D. | Al是電池負極,開始工作時溶液中會立即有白色沉淀析出 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | Fe | B. | Mg | C. | Al | D. | Zn |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 將一定質量的Mg和Al的混合物投入2.0mol•L-1,250mL稀硫酸中,固體全部溶解并產生氣體.待反應完全后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量與加入NaOH溶液的體積關系如圖示.則下列說法正確的是( )
將一定質量的Mg和Al的混合物投入2.0mol•L-1,250mL稀硫酸中,固體全部溶解并產生氣體.待反應完全后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量與加入NaOH溶液的體積關系如圖示.則下列說法正確的是( )| A. | 當加氫氧化鈉溶液體積為20mL時,溶液的pH值等于7 | |
| B. | 當加氫氧化鈉溶液體積為20mL時,溶液中的溶質只有硫酸鎂和硫酸鋁 | |
| C. | NaOH溶液的物質的量濃度為5 mol•L-1 | |
| D. | 生成的H2在標準狀況下的體積為11.2L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol任何物質都含有6.02×1021個原子, | |
| B. | 0.012kg12C含有6.02×1023碳原子 | |
| C. | 阿伏伽德羅常數表示的粒子“集體”就是1mol | |
| D. | 使用摩爾這一單位時必須指明粒子的名稱 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
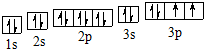 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com