
分析 (1)化學平衡常數是指:一定溫度下,可逆反應到達平衡時,生成物的濃度系數次冪之積與反應物的濃度系數次冪之積的比,固體、純液體不需要在化學平衡常數中寫出;
(2)相同溫度下,CO(g)+H2O(g)═CO2(g)+H2(g)的平衡常數與CO2(g)+H2(g)═CO(g)+H2O(g)的平衡常數互為倒數;
反應$\frac{1}{2}$CO2(g)+$\frac{1}{2}$H2(g)═$\frac{1}{2}$CO(g)+$\frac{1}{2}$H2O(g)的平衡常數為CO2(g)+H2(g)═CO(g)+H2O(g)的平衡常數的平方根;
(3)升高溫度平衡常數增大,說明升高溫度平衡正向移動,則正反應為吸熱反應;
(4)計算此時濃度商Qc,若Qc=K,處于平衡狀態,若Qc<K,反應向正反應進行,若Qc>K,反應向逆反應進行.
解答 解:(1)CO2(g)+H2(g)═CO(g)+H2O(g)的化學平衡常數表達式K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$,
故答案為:$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$;
(2)700℃時,CO2(g)+H2(g)═CO(g)+H2O(g)的平衡常數K1=0.5,相同溫度下,CO(g)+H2O(g)═CO2(g)+H2(g)的平衡常數K2=$\frac{1}{0.5}$=2,反應$\frac{1}{2}$CO2(g)+$\frac{1}{2}$H2(g)═$\frac{1}{2}$CO(g)+$\frac{1}{2}$H2O(g)的平衡常數K3=$\sqrt{0.5}$=0.71,
故答案為:2;0.71;
(3)升高溫度平衡常數增大,說明升高溫度平衡正向移動,則正反應為吸熱反應,
故答案為:吸熱;
(4)在1000℃下,某時刻CO2的物質的量為2mol,則:
CO2(g)+H2(g)═CO(g)+H2O(g)
起始量(mol):3 2 0 0
變化量(mol):1 1 1 1
某時刻(mol):2 1 1 1
此時濃度商Qc=$\frac{1×1}{2×1}$=0.5<K=,反應向正反應進行,則v(正)>v(逆),
故答案為:>.
點評 本題考查化學平衡常數表達式、平衡常數計算與應用,掌握化學平衡常數的用途:1、判斷反應進行的程度,2、判斷反應的熱效應,3、判斷反應進行的方向,4、計算轉化率等.


 課時訓練江蘇人民出版社系列答案
課時訓練江蘇人民出版社系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe( N03)3溶液中加入過量HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 濃燒堿溶液中加入鋁片:2A1+20H-═2AlO2-+H2 | |
| C. | H2SO4與Ba(OH)2溶液反應:Ba2+OH-+H++SO42-═BaSO4+H2O | |
| D. | 將新制氫氧化銅懸濁液加入氨水中:Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH - |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | X、Y、Z的分子個數比為3:1:2 | |
| B. | X的生成速率與Z的生成速率相等 | |
| C. | 混合氣體的密度不再改變 | |
| D. | 單位時間內生成3n mol X,同時消耗n mol Y |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 綠色更淺 | B. | 綠色更深 | C. | 變黃 | D. | 無變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Al2O3可用作耐火材料 | |
| B. | Al(OH3)可用于中和胃酸過多 | |
| C. | Na2O2可用于呼吸面具和潛艇中作氧氣的來源 | |
| D. | NaHCO3的水溶液呈堿性,因此NaHCO3不能用作食品添加劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
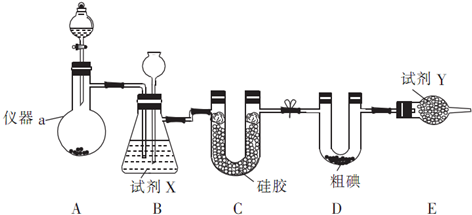
| 滴定次數 | 待測液體積/mL | Na2S2O3標準液體積/mL | |
| 滴定前讀數(mL) | 滴定后讀數(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
| 第三次 | 25.00 | 4.20 | 26.70 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com