關(guān)于原電池、電解池的電極名稱,下列說(shuō)法錯(cuò)誤的是( )
| A、原電池中失去電子的一極為負(fù)極 |
| B、電解池中與直流電源負(fù)極相連的一極為陰極 |
| C、原電池中相對(duì)活潑的一極為正極 |
| D、電解池中發(fā)生氧化反應(yīng)的一極為陽(yáng)極 |
考點(diǎn):原電池和電解池的工作原理
專題:
分析:原電池中,負(fù)極上失電子發(fā)生氧化反應(yīng),正極上得電子發(fā)生還原反應(yīng),所以較活潑的金屬作負(fù)極,較不活潑的電極為正極,電子從負(fù)極沿導(dǎo)線流向正極.而電解池的電極與電源有關(guān),與電源正極相連的為陽(yáng)極,與電源負(fù)極相連的為陰極,以此來(lái)解答.
解答:
解:A.原電池中負(fù)極失去電子,則失去電子的一極為負(fù)極,故A正確;
B.電解池中與電源的連接決定陰極或陽(yáng)極,則電解池中與直流電源負(fù)極相連的一極為陰極,故B正確;
C.一般來(lái)說(shuō),原電池中相對(duì)活潑的一極失去電子,為原電池的負(fù)極,故C錯(cuò)誤;
D.與電源正極相連的為陽(yáng)極,得到電子,發(fā)生氧化反應(yīng),故D正確;
故選C.
點(diǎn)評(píng):本題考查電化學(xué)反應(yīng)原理,為高頻考點(diǎn),把握正負(fù)極、陰陽(yáng)極的判斷方法為解答本題關(guān)鍵,注意原電池及電解池的區(qū)別,側(cè)重分析與應(yīng)用能力的考查,題目難度不大.
練習(xí)冊(cè)系列答案
相關(guān)習(xí)題
科目:高中化學(xué)
來(lái)源:
題型:
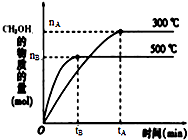
一定條件下,在體積為3L的密閉容器中反應(yīng)CO(g)+2H
2(g)?CH
3OH(g)達(dá)到化學(xué)平衡狀態(tài).
(1)500℃時(shí),從反應(yīng)開(kāi)始到達(dá)到化學(xué)平衡,以H
2的濃度變化表示的化學(xué)反應(yīng)速率是
(用含圖中字母的代數(shù)式表示).
(2)判斷該可逆反應(yīng)達(dá)到化學(xué)平衡狀態(tài)的標(biāo)志是
(填字母).
A.v
消耗(CH
3OH)=2v
消耗(H
2)
B.CO、H
2、CH
3OH的濃度均不再變化
C.混合氣體的平均相對(duì)分子質(zhì)量不再改變
D.混合氣體的密度不再改變
(3)300℃時(shí),將容器的容積壓縮到原來(lái)的
,在其他條件不變的情況下,對(duì)平衡體系產(chǎn)生的影響是
(填字母).
A.c(H
2)減少
B.正反應(yīng)速率加快,逆反應(yīng)速率減慢
C.CH
3OH 的物質(zhì)的量增加
D.重新平衡時(shí)c(H
2)/c(CH
3OH)減小.
查看答案和解析>>
科目:高中化學(xué)
來(lái)源:
題型:
回答下列問(wèn)題
1)、已知常溫下,在NaHSO3溶液中c(H2SO3 )<c(SO32-),且H2SO3的電離平衡常數(shù)為K1=1.5×10-2K2=1.1×10-7;氨水的電離平衡常數(shù)為K=1.8×10-2;
則等物質(zhì)的量濃度的下列五種溶液:①NH3?H2O ②(NH4)2CO3③KHSO3 ④KHCO3⑤Ba(OH)2,溶液中水的電離程度由大到小排列順序?yàn)?div id="p9vv5xb5" class='quizPutTag' contenteditable='true'>
2)、NaHSO
3具有較強(qiáng)還原性可以將碘鹽中的KIO
3氧化為單質(zhì)碘,試寫出此反應(yīng)的離子反應(yīng)方程式
3)、在濃NH
4Cl溶液中加入鎂單質(zhì),會(huì)產(chǎn)生氣體,該氣體成分是
,用離子方程式表示產(chǎn)生上述現(xiàn)象的原因:
.
查看答案和解析>>
科目:高中化學(xué)
來(lái)源:
題型:
現(xiàn)有金屬單質(zhì)A、B和氣體甲、乙、丙及物質(zhì)C、D、E、F、G,金屬A焰色反應(yīng)為黃色,它們之間能發(fā)生如下反應(yīng)(圖中有些反應(yīng)的產(chǎn)物和反應(yīng)的條件沒(méi)有全部標(biāo)出).
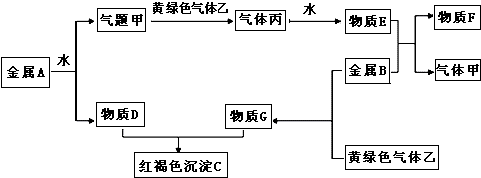
請(qǐng)根據(jù)以上信息回答下列問(wèn)題:
(1)寫出下列物質(zhì)的化學(xué)式:乙
丙
F
(2)寫出下列反應(yīng)的離子方程式:
①金屬A和水反應(yīng)
②D和G的水溶液反應(yīng)
(3)將G溶液逐滴加入到沸水中會(huì)產(chǎn)生一種紅褐色的液體.你認(rèn)為該液體中的分散質(zhì)粒子直徑在
之間,驗(yàn)證的簡(jiǎn)單方法是:
.
查看答案和解析>>
科目:高中化學(xué)
來(lái)源:
題型:
在25℃時(shí),物質(zhì)的濃度相等的NH4Cl、CH3COONH4、NH4HSO4的溶液中,其對(duì)應(yīng)溶液pH分別為a、b、c(單位為mol?L-1),下列判斷正確的是( )
| A、a=b=c |
| B、A=b>c |
| C、b>a>c |
| D、c>a>b |
查看答案和解析>>
科目:高中化學(xué)
來(lái)源:
題型:
工業(yè)廢水中常含有一定量的Cr
2O
72-和CrO
42-,它們會(huì)對(duì)生態(tài)系統(tǒng)造成很大的損害,其中還原沉淀法是常用的一種處理方法.流程如下:CrO
Cr
2O
Cr
3+Cr(OH)
3↓,其中第①步中存在平衡:2CrO
42-(黃色)+2H
+?Cr
2O
72-(橙色)+H
2O.下列有關(guān)說(shuō)法正確的是( )
| A、第①步當(dāng)2c (Cr2O72-)=c(CrO42-)時(shí),達(dá)到了平衡狀態(tài) |
| B、對(duì)于上述平衡,加入適量稀硫酸后,溶液顏色變黃色,則有利于CrO42-的生成 |
| C、Cr(OH)3是一種兩性氫氧化物,所以像Al(OH)3一樣能溶于氨水和碳酸溶液中 |
| D、第②步中,還原0.1 mol Cr2O72-需要91.2 g FeSO4 |
查看答案和解析>>
科目:高中化學(xué)
來(lái)源:
題型:
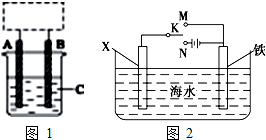
I.某學(xué)生設(shè)計(jì)了如圖1所示的裝置(框內(nèi)部分未畫出),在裝置內(nèi)起初發(fā)生的反應(yīng)為Cu+H
2SO
4=H
2↑+CuSO
4,試回答:
(1)該裝置的名稱是
(填“電解池”或“原電池”).
(2)A、B中至少有一種是金屬
(填名稱),接電源的
(填“正極”或“負(fù)極”).
(3)寫出該裝置中發(fā)生還原反應(yīng)的電極反應(yīng)方程式為
.
(4)若C溶液為100ml飽和食鹽水,A 和B電極均為碳棒,該學(xué)生利用如圖2所示裝置進(jìn)行電解,寫出該電解過(guò)程中的總反應(yīng)的離子方程式
,
當(dāng)放出標(biāo)況下112ml氫氣時(shí),該溶液的pH=
(室溫下).
II.利用如圖2裝置,可以模擬鐵的電化學(xué)防護(hù).若X為銅,為減緩鐵的腐蝕,開(kāi)關(guān)K應(yīng)置于
處.
若X為鋅棒,開(kāi)關(guān)K置于M處,該電化學(xué)防護(hù)法稱為
.
查看答案和解析>>
科目:高中化學(xué)
來(lái)源:
題型:
某化學(xué)興趣小組為了探究常溫下某非金屬氧化物形成的未知?dú)怏w的成分,將氣體通入澄清石灰水,發(fā)現(xiàn)澄清石灰水變渾濁,持續(xù)通入發(fā)現(xiàn)渾濁又變澄清,由此該小組成員對(duì)氣體的成分提出猜想.
Ⅰ【提出猜想】
猜想1:只有SO
2氣體
猜想2:只有CO
2氣體
猜想3:
.
Ⅱ?yàn)榱蓑?yàn)證猜想,該小組設(shè)計(jì)實(shí)驗(yàn)加以探究:
【實(shí)驗(yàn)探究】
該小組同學(xué)按如圖所示裝置,將氣體從a端通入,則:
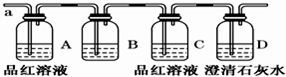
(1)B中應(yīng)該裝下列
試劑(填編號(hào)).
A.NaCl溶液 B.KMnO
4溶液 C.鹽酸 D.澄清石灰水
(2)A中品紅溶液的作用是:
.C中品紅溶液的作用是:
.
(3)D中澄清石灰水的作用是:
.
(4)通過(guò)該實(shí)驗(yàn),該小組同學(xué)觀察到以下三個(gè)實(shí)驗(yàn)現(xiàn)象:
①A中品紅溶液退色 ②C中品紅溶液退色 ③D中澄清石灰水變渾濁
由上述現(xiàn)象該小組同學(xué)確認(rèn)猜想1正確,你認(rèn)為
(填正確、錯(cuò)誤、不一定)理由是(填正確不用答)
(5)通過(guò)該實(shí)驗(yàn),該小組同學(xué)觀察到以下三個(gè)實(shí)驗(yàn)現(xiàn)象,
①A中品紅溶液退色 ②C中品紅溶液不退色 ③D中澄清石灰水變渾濁
由此可以確定上述那個(gè)猜想正確
.
(6)如果只驗(yàn)證猜想2,有同學(xué)認(rèn)為上述A、B、C三個(gè)裝置不需要,你認(rèn)為可行嗎?闡述你的理由:
.
查看答案和解析>>
科目:高中化學(xué)
來(lái)源:
題型:
已知反應(yīng)Na
2S
2O
3+H
2SO
4=Na
2SO
4+S↓+SO
2+H
2O,下列各組實(shí)驗(yàn)中反應(yīng)最快的是( )
| 組號(hào) | 反應(yīng)溫度
(℃) | 參加反應(yīng)的物質(zhì) | 體積(mL) |
| Na2S2O3 | H2SO4 |
| 體積(mL) | 濃度( mol?L-1 ) | 體積(mL) | 濃度( mol?L-1) |
| A | 10 | 5 | 0.1 | 10 | 0.1 | 15 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 20 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 20 |
| D | 30 | 10 | 0.08 | 15 | 0.08 | 5 |
查看答案和解析>>



 高中必刷題系列答案
高中必刷題系列答案
 一定條件下,在體積為3L的密閉容器中反應(yīng)CO(g)+2H2(g)?CH3OH(g)達(dá)到化學(xué)平衡狀態(tài).
一定條件下,在體積為3L的密閉容器中反應(yīng)CO(g)+2H2(g)?CH3OH(g)達(dá)到化學(xué)平衡狀態(tài).
 I.某學(xué)生設(shè)計(jì)了如圖1所示的裝置(框內(nèi)部分未畫出),在裝置內(nèi)起初發(fā)生的反應(yīng)為Cu+H2SO4=H2↑+CuSO4,試回答:
I.某學(xué)生設(shè)計(jì)了如圖1所示的裝置(框內(nèi)部分未畫出),在裝置內(nèi)起初發(fā)生的反應(yīng)為Cu+H2SO4=H2↑+CuSO4,試回答: