
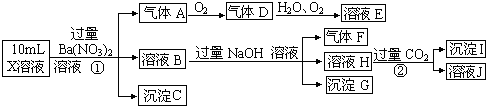
分析 在強酸性溶液中一定不會存在CO32-和SO32-離子,加入過量硝酸鋇生成沉淀,則該沉淀為BaSO4沉淀,說明溶液中含有SO42-離子,生成氣體A,A連續氧化生成D和E,則A為NO,D為NO2,E為HNO3,說明溶液中含有還原性離子,一定為Fe2+離子,溶液B中加入過量NaOH溶液,生成氣體F,則F為NH3,說明溶液中含有NH4+離子,溶液H中溶于CO2氣體,生成沉淀I,則I為Al(OH)3,H為NaAlO2,說明溶液中含有Al3+離子,溶液中含有Fe2+離子,就一定不含NO3-離子,含有SO42-離子就一定不含Ba2+離子,不能確定的是否含有的離子Fe3+和Cl-,以此解答(1)(2)題,根據溶液電中性解答(3)題.
解答 解:(1)在強酸性溶液中一定不會存在CO32-和SO32-離子,加入過量硝酸鋇生成沉淀,則該沉淀為BaSO4沉淀,說明溶液中含有SO42-離子,生成氣體A,A連續氧化生成D和E,則A為NO,D為NO2,E為HNO3,說明溶液中含有還原性離子,一定為Fe2+離子,溶液B中加入過量NaOH溶液,生成氣體F,則F為NH3,說明溶液中含有NH4+離子,溶液H中溶于CO2氣體,生成沉淀I,則I為Al(OH)3,H為NaOH和NaAlO2,說明溶液中含有Al3+離子,溶液中含有Fe2+離子,就一定不含NO3-離子,含有SO42-離子就一定不含Ba2+離子,不能確定是否含有的離子Fe3+和Cl-,檢驗氯離子的方法是:取少量B溶液放在試管中,加入幾滴AgNO3溶液,無白色沉淀說明無Cl-,
故答案為:Al3+、NH4+、Fe2+、SO42-;Fe3+、Cl-;用試管取少量X溶液,加入足量硝酸鋇溶液,靜置取上層清夜,滴加AgNO3溶液,無白色沉淀說明無Cl-;
(2)①Fe2+離子被氧化為Fe3+離子,反應的離子方程式為3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;②H為NaOH和NaAlO2混合物,通入過量二氧化碳后分別發生的反應為:CO2+OH-=HCO3-,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案為:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;CO2+OH-=HCO3-,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)A、F、I均為0.01mol,10mL X溶液中n(H+)=0.02mol,根據反應3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知3Fe2+離子為0.03mol,根據溶液電中性可知:2n(Fe2+)+3n(Al3+)+n(NH4+)+n(H+)=2n(SO42-),n(SO42-)=$\frac{2×0.03mol+3×0.01mol+0.01mol+0.02mol}{2}$=0.06mol,當沉淀C物質的量>0.06mol時一定含有Fe3+離子,故答案為:>0.06.
點評 本題為考查離子組推斷題,題目具有一定難度,本題解答時一定要緊扣反應現象,推斷各離子存在的可能性,本題易錯點為(3)題,注意溶液電中性的利用.


 品學雙優卷系列答案
品學雙優卷系列答案 小學期末沖刺100分系列答案
小學期末沖刺100分系列答案 期末復習檢測系列答案
期末復習檢測系列答案 超能學典單元期中期末專題沖刺100分系列答案
超能學典單元期中期末專題沖刺100分系列答案科目:高中化學 來源: 題型:選擇題
| A. | 光導纖維、防彈玻璃、氧化鋁陶瓷、硅藻土都是無機非金屬材料,PLA、PE、橡膠、酚醛樹脂都是人工合成高分子材料 | |
| B. | 貯氫金屬并不是簡單地吸附氫氣,而是通過化學反應貯存氫氣 | |
| C. | 科學家發現一種新的CO2晶體,該CO2晶體具有極強的硬度,是由CO2分子構成的空間立體網狀結構 | |
| D. | 最新的氯堿工業是用離子交換膜電解槽電解飽和食鹽水來生產氫氣、氯氣和燒堿的,電解槽中的離子交換膜既可以用陽離子交換膜也可以用陰離子交換膜 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 丙烯分子中有8個σ鍵,1個π鍵 | |
| B. | 在SiO2晶體中,1個Si原子和2個O原子形成2個共價鍵 | |
| C. | NF3的沸點比NH3的沸點低得多,是因為NH3分子間有氫鍵,NF3只有范德華力 | |
| D. | NCl3和BC13分子中,中心原子都采用sp3雜化 | |
| E. | 在“冰→水→水蒸氣→氧氣和氫氣”的變化過程中,各階段被破壞的粒子間主要的相互作用依次是氫鍵、分子間作用力、極性鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 78 gNa2O2晶體中所含陰陽離子個數均為2NA | |
| B. | 1.5 g CH3+中含有的電子數為NA | |
| C. | 3.4 g氨氣分子中含有0.6NA個N-H鍵 | |
| D. | 常溫下,100 mL1 mol•L-1AlCl3溶液中Al3+離子總數等于0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 編號 | A | B | C | D |
實驗 裝置 |  | 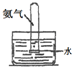 | 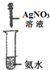 | 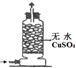 |
| 實驗 目的 | 實驗室模擬侯氏制堿法制備NH4HCO3 | 驗證NH3易溶于水 | 制備銀氨溶液 | 干燥NH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.4mol | B. | 0.3 mol | C. | 0.2mol | D. | 0.1 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com