
| 電離能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
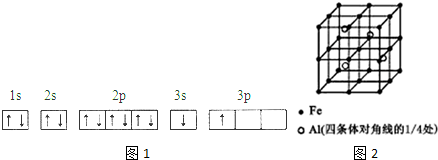
 .
.分析 (1)①由圖1電子軌道排布圖可知,3s能級未填滿就填充3p能級,3s能級能量比3p能級低,每個軌道最多只能容納兩個電子,且自旋相反;
由表中電離能可知,二者第三電離能劇增,故為+2價,都為短周期元素,故A為鈹、B為Mg,鎂價層電子排布為3s2;
②BeCl2分子中Be的成2個σ鍵,雜化軌道數為2,采取sp雜化,沒有孤對電子對,為直線型;
(2)①體心立方堆積,如: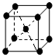 ,屬于鉀、鈉和鐵型,其原子的配位數為8;
,屬于鉀、鈉和鐵型,其原子的配位數為8;
②等電子體中原子個數相等、價電子數相等,CN-含有2個原子、價電子數是10,與單質氮氣分子是等電子體關系;
③六氰合亞鐵離子[Fe(CN)6]4-中存在配位鍵,極性共價鍵,CN-電子式為 ,則C、N間存在σ鍵和π鍵;
,則C、N間存在σ鍵和π鍵;
(3)①由晶胞圖2,晶胞中含有4個Al原子,且都位于晶胞內部,則晶胞平均含有4個Al,晶胞中Fe位于頂點的有8個,位于面心的有6個,位于棱上的有12個,位于體心的有1個,根據均攤法計算;
②一個晶胞中含有8個Fe原子和4個Al原子,合金中最近的兩個Fe原子之間的距離為xcm,則棱長為2xcm,體積為8x3cm3,晶胞質量為$\frac{56×8+27×4}{{N}_{A}}$g,結合ρ=$\frac{m}{V}$計算.
解答 解:(1)①由圖1電子軌道排布圖可知,3s能級未填滿就填充3p能級,所以違背能量最低原理;由表中電離能可知,二者第三電離能劇增,故為+2價,都為短周期元素,故A為鈹、B為Mg,鎂價層電子排布為3s2,處于周期表中s區,
故答案為:能量最低原理;s;
②BeCl2分子中Be的成2個σ鍵,雜化軌道數為2,采取sp雜化,沒有孤對電子對,為直線型,故答案為:sp;直線形;
(2)①體心立方堆積,如: ,屬于鉀、鈉和鐵型,其原子的配位數為8,故答案為:8;
,屬于鉀、鈉和鐵型,其原子的配位數為8,故答案為:8;
②等電子體中原子個數相等、價電子數相等,CN-含有2個原子、價電子數是10,與單質氮氣分子是等電子體關系,氮氣的電子式為 ,
,
故答案為: ;
;
③六氰合亞鐵離子[Fe(CN)6]4-中存在配位鍵,極性共價鍵,CN-電子式為 ,則C、N間存在σ鍵和π鍵,
,則C、N間存在σ鍵和π鍵,
故答案為:B;
(3)①由晶胞圖2,晶胞中含有4個Al原子,且都位于晶胞內部,則晶胞平均含有4個Al,晶胞中Fe位于頂點的有8個,位于面心的有6個,位于棱上的有12個,位于體心的有1個,含有Fe原子數目為8×$\frac{1}{8}$+6×$\frac{1}{2}$+12×$\frac{1}{4}$+1=8,Fe與 Al原子數目之比為8:4=2:1,故該合金的化學式為Fe2Al,故答案為:Fe2Al;
②一個晶胞中含有8個Fe原子和4個Al原子,設合金中最近的兩個Fe原子之間的距離為xcm,則棱長為2xcm,體積為8x3cm3,晶胞質量為$\frac{56×8+27×4}{{N}_{A}}$g,由ρ=$\frac{m}{V}$可知,8x3=$\frac{139}{ρ{N}_{A}}$,則x=$\root{3}{\frac{139}{2ρ{N}_{A}}}$cm,故答案為:$\root{3}{\frac{139}{2ρ{N}_{A}}}$.
點評 本題考查物質結構和性質,為高頻考點,側重對物質結構主干知識的考查,涉及雜化理論、化學鍵、分子結構與性質、晶胞計算等,需要學生具備知識的基礎,題目難度中等,注意對晶胞計算中的常用的均攤法的理解及應用.


 第1卷單元月考期中期末系列答案
第1卷單元月考期中期末系列答案科目:高中化學 來源: 題型:選擇題
| A. | 有單質生成的反應一定是氧化還原反應 | |
| B. | 在氧化還原反應中,非金屬單質一定是氧化劑 | |
| C. | 反應前后有元素化合價變化的反應一定是氧化還原反應 | |
| D. | 金屬陽離子被還原一定得到金屬單質 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用水鑒別炭粉和二氧化錳 | |
| B. | 用聞氣味的方法鑒別白酒和白醋 | |
| C. | 用澄清石灰水鑒別氮氣和二氧化碳 | |
| D. | 用相互刻畫的方法鑒別黃銅片和銅片 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
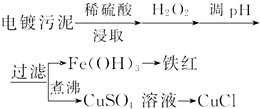
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 開始沉淀的pH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 6.4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com