

| A. | 燃料電池工作時,正極反應為O2+2H2O+4e-═4OH- | |
| B. | 此裝置用于鐵表面鍍銅時,a為鐵b為Cu,工作一段時間要使右池溶液復原可加入適量的CuO | |
| C. | a極是粗銅,b極是純銅時,a極逐漸溶解,b極上有銅析出 | |
| D. | 若a、b兩極均為石墨時,在相同條件下,a極產生的氣體與電池中消耗的H2體積相同 |
分析 左邊裝置是氫氧燃料電池,所以是原電池,原電池放電時,燃料失電子發生氧化反應,所以投放燃料氫氣的電極為負極,投放氧化劑氧氣的電極為正極,正極上氧化劑得電子發生還原反應,由于電解質溶液呈酸性,正極反應為:O2+4e-+4H+=2H2O;右邊裝置有外接電源,所以是電解池,連接負極的b電極是陰極,連接正極的a電極是陽極,陽極上失電子發生氧化反應,陰極上得電子發生還原反應,結合電解反應解答.
解答 解:A.因該燃料電池是在酸性電解質中工作,所以正極反應為:O2+4e-+4H+=2H2O,故A錯誤;
B.若要實現鐵上鍍銅,鍍層金屬應為電解池的陽極,則a極是銅,b極是鐵,故B錯誤;
C.a與電池正極相連,a為電解池陽極,b與電池的負極相連,b為電解池陰極,則a極是粗銅,b極是純銅時,a極的Cu溶解,b極上析出Cu,故C正確;
D.a、b兩極均是石墨時,電解CuSO4溶液時,a極產生的氣體為O2,產生1molO2需4mol電子,所以需要燃料電池的2molH2,二者的體積并不相等,故D錯誤;
故選C.
點評 本題考查原電池和電解池的知識,題目難度中等,解答此種類型的題目的關鍵是能把握電化學原理,能正確書寫電極反應式.


 階梯計算系列答案
階梯計算系列答案科目:高中化學 來源: 題型:選擇題
| A. | 該物質既能與強酸反應又能與強堿反應 | |
| B. | 該物質是Al(OH)3和Na2CO3的混合物 | |
| C. | 1 mol[NaAl(OH)2CO3]最多可消耗4 mol H+ | |
| D. | 該藥劑不適合于胃潰瘍患者服用 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 氫氣在氯氣中燃燒,火焰呈淡藍色,瓶口出現大量暈白霧 | |
| B. | 將新制的氯氣通入AgNO3溶液中,白色沉淀生成. | |
| C. | 銅在氯氣中燃燒,產生大量棕色的煙,加水溶解后可得藍綠色溶液 | |
| D. | 用潔凈的鉑絲沾取碳酸鉀粉末在酒精燈火焰上灼燒,可觀察到明亮的紫色火焰 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯能使酸性高錳酸鉀溶液褪色,是因為乙烯分子中含有碳碳雙鍵 | |
| B. | 甲烷和氫氣都可以與氯氣反應,且反應類型相同 | |
| C. | 用酸性重鉻酸鉀溶液檢驗酒駕,發生的反應屬于乙醇的氧化反應 | |
| D. | 氨基酸分子中均含有羧基(-COOH)和氨基(-NH2) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 溫度/℃ | 25 | 80 | 230 |
| 平衡常數 /mol-3•L3 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述生成Ni(CO)4(g)的反應為放熱反應 | |
| B. | 在25℃時,反應Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常數為2×10-5 mol3•L-3 | |
| C. | 在80℃時,測得某時刻,Ni(CO)4、CO濃度均為0.5 mol•L-1,則此時v正>v逆 | |
| D. | 在80℃達到平衡時,測得n(CO)=0.3 mol,則Ni(CO)4的平衡濃度為2 mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol甲烷和1mol氯氣在光照條件下充分反應,生成1mol CH3Cl | |
| B. | 等物質的量的乙烯與碳酸二甲酯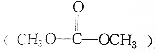 完全燃燒耗氧量相同 完全燃燒耗氧量相同 | |
| C. | 苯和液溴在FeCl3的催化作用下發生加成反應 | |
| D. | 苯在工業上可通過石油分餾得到 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Q1>Q2 | B. | Q1=Q2 | C. | Q1<Q2 | D. | 無法比較 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol | B. | 0.05 mol | C. | 1.05 mol | D. | 0.11 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,14g由N2和CO組成的混合氣體中含有的電子總數為7 NA | |
| B. | 常溫下,1 L pH=1的硫酸溶液中含有的H+數目為0.2 NA | |
| C. | 1 L 0.1 mol/L Na2CO3溶液中含有的CO32-數目為0.1 NA | |
| D. | 一定條件下,6.4 g SO2和足量的O2充分反應后,生成SO3的分子數為0.1NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com