
| A. | x=1 | |
| B. | 2 min內A的反應速率為0.3 mol/(L•min) | |
| C. | B的轉化率為40% | |
| D. | 若混合氣體的密度不變,則表明該反應達到平衡狀態 |
分析 A.根據n=cV計算生成C的物質的量,結合D的物質的量,利用物質的量之比等于化學計量數之比計算x的值;
B.根據v=$\frac{\frac{△n}{V}}{△t}$計算v(D),再利用速率之比等于化學計量數之比計算v(A);
C.根據生成的D的物質的量,利用物質的量之比等于化學計量數之比計算參加反應的B的物質的量,再利用轉化率定義計算;
D.容器的容積不變,混合氣體的質量不變,密度為定值,始終不變.
解答 解:A.平衡時生成的C的物質的量為0.2mol•L-1×2L=0.4mol,物質的量之比等于化學計量數之比,故0.4mol:0.8mol=x:2,解得x=1,故A正確;
B.2min內生成0.8mol D,故2 min內D的反應速率v(D)=$\frac{\frac{0.8mol}{2L}}{2min}$=0.2 mol•(L•min)-1,速率之比等于化學計量數之比,故v(A)=$\frac{3}{2}$v(D)=$\frac{3}{2}$×0.2 mol•(L•min)-1=0.3 mol•(L•min)-1,故B正確;
C.2min末該反應達到平衡,生成0.8mol D,由方程式3A(g)+B(g)?xC(g)+2D(g)可知,參加反應的B的物質的量為:0.8mol×$\frac{1}{2}$=0.4mol,故B的轉化率為$\frac{0.4mol}{1mol}$=100%=40%,故C正確;
D.容器的容積不變,混合氣體的質量不變,密度為定值,始終不變,故混合氣體的密度不變,不能說明反應達到平衡狀態,故D錯誤;
故選D.
點評 本題考查化學平衡的有關計算、反應速率的有關計算、平衡狀態的判斷等知識,題目難度中等,注意掌握平衡狀態的特征及三段式列式計算是解題的基本方法,試題培養了學生的分析能力及化學計算能力.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用過濾的方法分離溶液和膠體 | |
| B. | 用四氯化碳萃取碘水中的碘 | |
| C. | 用蒸餾的方法將自來水制成蒸餾水 | |
| D. | 用加熱的方法分離氯化鈉和單質碘固體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬鈉存放在試劑瓶中的煤油里 | |
| B. | 存放液溴的試劑瓶中應加水封 | |
| C. | 硝酸應用棕色瓶盛裝且避光存放 | |
| D. | 燒堿應盛放在玻璃塞的磨口玻璃瓶中 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應中共消耗1.75 mol H2SO4 | B. | 氣體甲中SO2與H2的體積比為1:4 | ||
| C. | 反應中共消耗65 g Zn | D. | 反應中共轉移3.6 mol電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 通空氣時,銅被腐蝕,表面產生CuO | |
| B. | 放電時,Li+透過固體電解質向Cu極移動 | |
| C. | 放電時,正極的電極反應式為Cu2O+H2O+2e-═2Cu+2OH- | |
| D. | 整個反應過程中,銅相當于催化劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | △H<0、△S>0的反應在任何溫度下都能自發進行 | |
| B. | NH4HCO3(s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自發進行,原因是體系有自發地向混亂度增加的方向轉變的傾向 | |
| C. | 硝酸銨固體的溶解過程與焓變有關 | |
| D. | 在其他外界條件不變的情況下,使用催化劑,可以改變化學反應進行的速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
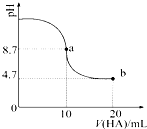 室溫下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的
室溫下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的| A. | a點所示溶液中c(HA)>c(A-) | |
| B. | a點所示溶液中c(Na+)=c(A-)+c(HA) | |
| C. | 當加入HA溶液10mL時,c(OH-)<1.0×10-7mol•L-1 | |
| D. | b點所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com