
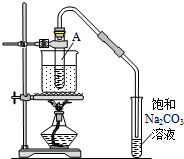
 按如圖所示裝置,在試管A里加入3mL乙醇和2mL冰醋酸,然后一邊搖動,一邊慢慢地加入2mL濃硫酸,再加入少量碎瓷片,用酒精燈加熱10min,結果在飽和碳酸鈉溶液的液面上沒有無色油狀液體,下列對其原因的分析錯誤的是( )
按如圖所示裝置,在試管A里加入3mL乙醇和2mL冰醋酸,然后一邊搖動,一邊慢慢地加入2mL濃硫酸,再加入少量碎瓷片,用酒精燈加熱10min,結果在飽和碳酸鈉溶液的液面上沒有無色油狀液體,下列對其原因的分析錯誤的是( )| A. | 試管A中沒有發生反應 | |
| B. | 熱源小、水量多,水浴升溫速度太慢 | |
| C. | 產物蒸汽在試管A上部全部被冷凝回流 | |
| D. | 產物已全部溶解在飽和Na2CO3溶液中 |
分析 乙酸與乙醇在濃硫酸作用下加熱發生酯化反應生成乙酸乙酯和水,方程式為CH3COOH+C2H5OH$?_{△}^{濃硫酸}$CH3COOC2H5+H2O,反應需在加熱條件下進行,生成的乙酸乙酯不溶于飽和碳酸鈉溶液,長導管起到冷凝回流的作用,以此解答該題.
解答 解:A.乙醇、乙酸在濃硫酸作用下,加熱可發生酯化反應生成乙酸乙酯,故A錯誤;
B.如燒杯內加水過多,反應溫度較低,則反應較慢,可能收集不到乙酸乙酯,故B正確;
C.如生成乙酸乙酯較少,產物蒸汽在試管A上部全部被冷凝回流,也可能收集不到乙酸乙酯,故C正確;
D.乙酸乙酯不溶于飽和碳酸鈉溶液,故D錯誤.
故選AD.
點評 本題考查乙酸乙酯的制備,為高頻考點,題目難度中等,本題注意把握乙酸乙酯的制備原理和實驗方法,學習中注重實驗評價能力的培養.


科目:高中化學 來源: 題型:解答題
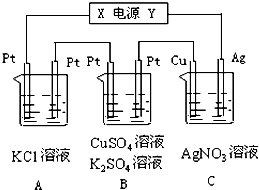 如圖所示,若電解5min時銅電極質量增加2.16g,試回答:
如圖所示,若電解5min時銅電極質量增加2.16g,試回答:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 A、B、C、D是元素周期表中前36號元素,它們的核電荷數依次增大.第二周期元素A原子的核外成對電子數是未成對電子數的2倍且有3個能級,B原子的最外層p軌道的電子為半充滿結構,C是地殼中含量最多的元素.D是第四周期元素,其原子核外最外層電子數與氫原子相同,其余各層電子均充滿.請回答下列問題:
A、B、C、D是元素周期表中前36號元素,它們的核電荷數依次增大.第二周期元素A原子的核外成對電子數是未成對電子數的2倍且有3個能級,B原子的最外層p軌道的電子為半充滿結構,C是地殼中含量最多的元素.D是第四周期元素,其原子核外最外層電子數與氫原子相同,其余各層電子均充滿.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
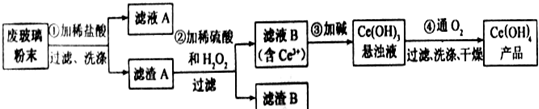
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 陰極:NaOH溶液質量分數 | 陽極:NaCl溶液濃度(g/L) | |
| 進料液 | 0.30 | 310 |
| 電解后 | 0.32 | 210 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
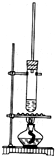 已知1-丁醇的沸點為117.7℃,乙酸的沸點為118℃,甲同學擬在濃硫酸作用下,使1-丁醇和乙酸進行酯化反應制乙酸丁酯(反應溫度115~125℃)
已知1-丁醇的沸點為117.7℃,乙酸的沸點為118℃,甲同學擬在濃硫酸作用下,使1-丁醇和乙酸進行酯化反應制乙酸丁酯(反應溫度115~125℃)查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
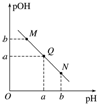
| A. | M點所示溶液的導電能力強于Q點 | |
| B. | N點所示溶液中c(CH3COO-)>c(Na+) | |
| C. | Q點水的電離程度在MN直線上最大 | |
| D. | Q點消耗NaOH溶液的體積小于醋酸溶液的體積 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com